MLCとは
概要
皮質下嚢胞をもつ大頭型白質脳症(Megalencephalic leukoencephalopathy with subcortical cysts;MLC)は,1995年にオランダのvan der knaap(ファンデルナップ)により報告された白質ジストロフィー※1のひとつです。症状として,大頭症,発達遅延,運動失調,痙縮,軽度認知障害,運動機能障害,てんかんなどが報告されていますが,発症年齢や進行速度は人によってさまざまです。疾患のタイプとして,症状が進行するMLC1,MLC2A,症状が改善あるいは正常化する寛解型のMLC2Bの3つに分類されます※2。MLC1型が本疾患の約76%を占めます。
※1 白質ジストロフィーとは
Leukodystrophy(白質ジストロフィー) は、白質脳症のうち遺伝的欠陥によって引き起こされる疾患であり、病理学的には進行性の症状とミエリン(髄鞘)障害によって特徴づけられます。ミエリンは,脳内の信号を伝達する軸索を覆う構造体であり,グリア細胞のひとつであるオリゴデンドロサイトにより作成されます。ミエリンの存在により脳内の信号伝達が円滑に行うことができますが,白質ジストロフィーでは,ミエリンに障害があるため信号伝達が円滑にいかず,様々な神経機能障害が引き起こされます。
よく似た用語にLeukoencephalopathy(白質脳症)がありますが,これはより広範な定義で,白質のみ,あるいは主に白質に関与する全ての障害のことを言い,遺伝性でない後天的な疾患や,進行性でないものも含まれます。例えば,多発性硬化症や進行性多巣性白質脳症(PML)などは,白質ジストロフィーではない白質脳症です。
【参考】Gene Reviews Japan
【参考】アムステルダム自由大学HP
※2 MLCのタイプについて
2023年の論文(Passchier et al.,2023)で,これまで臨床症状とMRIからMLCと診断されたが変異遺伝子が不明であった患者から,新しい2つの変異遺伝子GPRC5B,AQP4が発見され,それぞれMLC3,MLC4と命名されました。
| 表現型 | タイプ | 変異遺伝子 | 患者数割合 | |
| 古典型MLC | MLC1 | MLC1 | 常染色体劣性遺伝 | 約76% |
| MLC2A | HEPACAM(GlialCAM) | 常染色体劣性遺伝 | MLC2Bと合わせて約22% | |
| MLC3 | GPRC5B | 常染色体優性遺伝(2023年時点) | 1%未満 | |
| 寛解型MLC | MLC2B | HEPACAM(GlialCAM) | 常染色体優性遺伝 | MLC2Aと合わせて約22% |
| MLC4 | AQP4 | 常染色体劣性遺伝 | 1%未満 | |
| 不明 | 1%未満 | |||
症状
ほとんどの症例で最初に現れる症状は,生後早期の大頭症(頭囲の拡大)です。また,多くの症例で発達の軽度の遅延が見られます。
MLC1,MLC2Aの患者では,運動失調,痙縮,軽度認知障害,運動機能障害,てんかんなどの神経症状が現れます。症状は進行性の経過をたどる場合がほとんどですが、発症年齢や進行速度には人により大きなばらつきがあります。発症後数年で歩く能力を失いほとんどの日常生活に介助が必要なる人もいれば,成人期でも歩くことができ通常の仕事をする人もいます。今のところ,このばらつきの要因を説明できる知見は得られていません。頭部外傷や発熱を契機に症状が悪化する場合があります。
MLC2Bの患者では,一部不器用さや筋緊張の低下が見られますが,運動発達は概ね良好です。てんかんが見られる場合があります。また,自閉症や知的障害を伴う例も報告されています。
【参考】世界中242人のMLC患者(MLC1:187人,MLC2A:17人,MLC2B:38人)の症例報告
【参考】中国の27人のMLC1患者(1歳~13歳)の症例報告
病因
MLC1型の原因として、22番染色体の22q13.33という位置に存在するMLC1遺伝子が見つかっています。MLC1遺伝子は、脳および脾臓、白血球などに見られるMLC1タンパク質の設計図となる遺伝子です。MLC1型は、常染色体劣性(潜性)遺伝形式で遺伝します。MLC2A型、および2B型の原因遺伝子として、11番染色体の11q24.2という位置に存在するHEPACAM遺伝子が見つかっています。HEPACAM遺伝子は、脳のグリア細胞や肝臓で見られるGlialCAMタンパク質の設計図となる遺伝子です。MLC2A型は常染色体劣性(潜性)遺伝形式で、MLC2B型は常染色体優性(顕性)遺伝形式で遺伝します(遺伝性疾患プラス)。
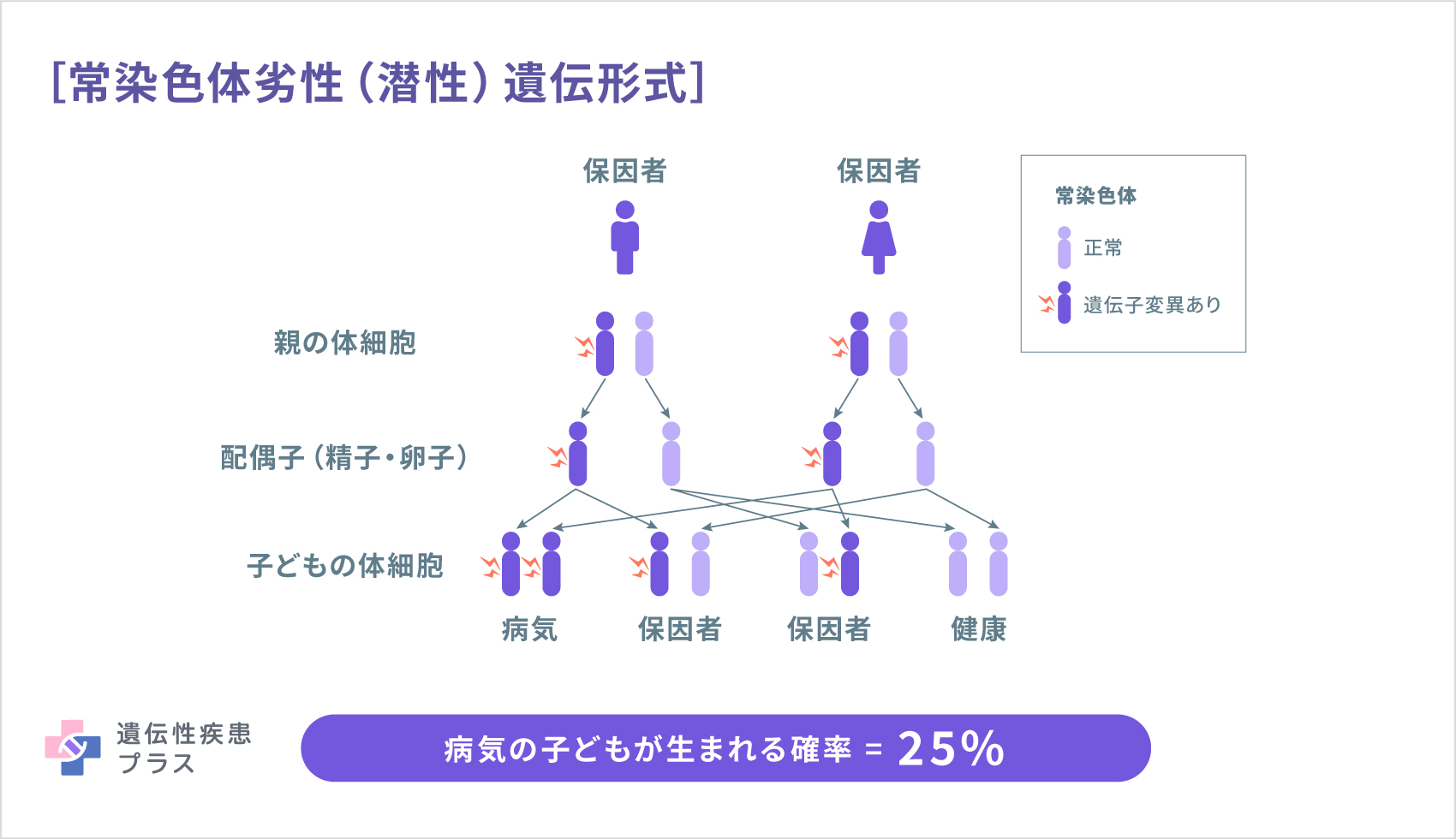
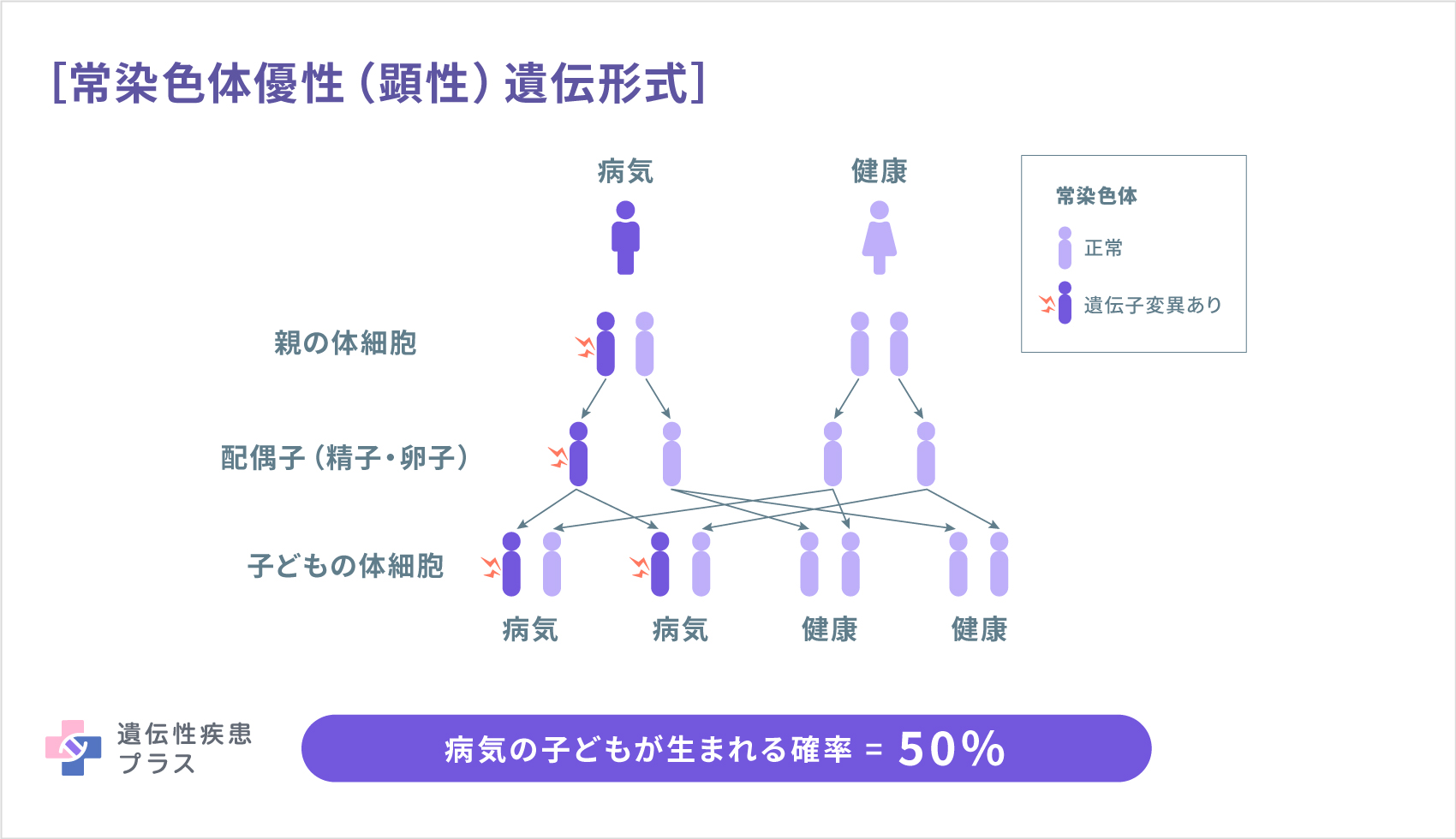
遺伝形式(遺伝性疾患プラスより転載)
MLC1タンパク質,GlialCAMタンパク質はいずれもグリア細胞のひとつであるアストロサイト(星状細胞)に主に存在し,グリア細胞のイオンや水の恒常性を保つ役割を持つ別のタンパク質(ClC-2チャネル,Na+/K+-ATPアーゼ,Ca2+-ATPアーゼ,V-ATPアーゼ,VRACチャネル,Cx43,TRPV4,Kir4.1,AQP4,など)の活性を制御する役割があると考えられています(Bosch et al.,2021)。
遺伝子変異によりMLC1あるいはGlialCAMがうまく働かない,あるいは,いるべき部位に生成されない(誤局在;mislocalization)ことで,上記イオンチャネルの活性化制御など本来の役割を果たせず,グリア細胞のイオン・水のバランスが崩れます。その結果(具体的なメカニズムは不明ですが),細胞体積の膨張や,同じグリア細胞であるオリゴデンドロサイトにより生成されるミエリンの空胞化(Vacuolization)が引き起こされます。ミエリンは,脳内の信号を伝達する軸索を覆う構造体であり,信号伝達速度を飛躍的に向上させる役割がありますが,その機能が空胞化により障害されることで,様々な神経機能障害が症状として現れると考えられています。
上記のグリア細胞の恒常性を保つ働きは定常的に行われていることですが,頭部外傷や発熱時にはより活発化するため,その制御がうまくいかない場合には定常時よりもさらに大きな影響を受けます。つまり,頭部外傷や発熱時に階段状に症状が進む場合があるというMLCの特徴は,この理由により説明できると考えられています。
なお,MLCの特徴のひとつである皮質下嚢胞の発生メカニズムや嚢胞による臨床症状への影響などは,明らかにされていません。
診断方法
MRIによる画像診断と臨床的兆候により診断されます。MRI画像は,特徴的なびまん性の大脳白質信号異常と,皮質下嚢胞の存在を示します。最終的には,遺伝子検査によるMLC1およびHEPACAM遺伝子の変異を確認することで確定されますが,どちらの変異も確認されず臨床症状とMRIにより診断される例も稀にあります。
治療
現在,確立された治療法はありません。発作を抑えるための抗てんかん薬など,発生した症状に対する支持的療法に留まります。
ただし,現在も日本及び諸外国で研究が続けられており,病態解明や治療法に関する知見は増えてきています。人間を対象とした臨床試験はまだ行われた例がありませんが,マウスやiPS細胞などを用いた病理モデルで遺伝子治療や分子標的薬などの既存薬の有効性を検証する研究が行われています。
・遺伝子治療
疾患の根本原因であるタンパク質(MLCで言うとMLC1あるいはGlialCAM)を修正するアプローチです。手法としてAAV(アデノウィルス随伴ベクター)を用いた遺伝子導入やLV(レンチウィルスベクター)を用いた造血幹細胞移植などが主流です。疾患の根本原因を修正するアプローチなので,MLC1やGlialCAMがほかのタンパク質に与える影響など,下流の複雑なメカニズムが完全に明らかでなくても治療法を確立することが可能と考えられます。Sánchez et al.(2020)では,MLC1のノックアウトマウスを対象とした遺伝子治療が行われており,AAVベクターによるアストロサイトをターゲットとした遺伝子導入を行い,ミエリン空胞化が有意に減少したことが示されています。しかし,マウスモデルが,人間のMLC患者の表現型を完全に再現できているわけではないことなど,人間を対象とした治療への展開においては課題が残されています。
・既存薬による治療
MLC1あるいはGlialCAMは,グリア細胞のイオン・水の恒常性に関与する他のタンパク質の活性を制御することが示されています。従って,遺伝子変異により失われたこれらの役割を薬剤により代替する治療アプローチが考えられます。例えば,Lanciotti et al.(2020),XabierElorza-Vidal et al.(2018)では,MLC1タンパクが正常に機能しない場合には,タンパク質の情報伝達経路であるシグナル分子「ERKキナーゼ」を経由して,前述のCx43やVRACなどのタンパク質が過剰に活性化されることが示されており,ERKキナーゼの活性化を阻害する薬剤の有効性が示唆されています。また,Lanciotti et al.(2016)では,MLC1変異が,アストロサイトなどの細胞増殖に関わるシグナル伝達分子「上皮成長因子受容体(EGFR)」の制御機構がうまく働かないため,細胞増殖が過剰になることが示されており,EGFRチロシンキナーゼ活性を阻害する薬剤の有効性が示唆されています。上記のシグナル分子に働きかける薬剤は「分子標的薬」と呼ばれており,がんの治療用として承認されている薬も多くあるため,遺伝子治療よりも早く治療法を確立できる可能性があります(つまり部分的にがんと同じメカニズムということになりますが,MLC患者において脳腫瘍が増加したという報告は今のところありません)。
ただし,複雑なMLCの病態の全体像が完全に明らかにされているわけではないので,特定の分子を標的とした薬剤で,大局的な効果が得られるかどうかはわかりません。
MLC1,2Aは基本的には進行性の疾患であり,治療を行わない限り運動機能・認知機能は速度の個人差はあれどほぼ例外なく退行の一途をたどると考えられています。しかし,治療研究において,ミエリン空胞化がかなり進んだ15か月齢のマウスにおいても遺伝子治療によりミエリン空胞化が正常化したこと(Sánchez et al.,2020)から,MLCは顕著な神経変性(細胞死など)はなく臨床表現型は可逆的である可能性があることが示唆されています。また,人間の表現型においても,Van der knaap(2016)において, MLCを含むミエリン空胞化を伴う白質ジストロフィーで可逆性を示唆する以下のような知見がレビューされています。
・寛解型であるMLC2Bでは,生後1~2年で一旦ミエリンの空胞化とみられるMRI白質信号異常が確認された後,その異常が正常化するとともに運動機能も正常化あるいは改善する(Hamilton et al., 2018)。
・GJB1遺伝子変異によるX連鎖シャルコー・マリー・トゥース病では,ミエリン空胞化とみられる一過性のMRI白質信号異常が発症する可能性がある(Depienne et al.2013,Paulson et al.,2002)。
・脳幹および脊髄の障害と乳酸上昇を伴う白質脳症(LTBL)では、乳児期にMRIで重度の白質脳症と拡散制限を伴う神経学的悪化を特徴とし、ミエリン微小空胞化を示唆しているが、その後,臨床およびMRIが改善され、ほとんどの異常が消失する症例がある(Steenweg et al.2012)。
・新生児メープルシロップ尿症は、新生児のミエリンを含む領域の急性ミエリン微小空胞化を特徴とし、異常は適切な治療で回復可能である(Jan et al.,2003)。
従って,ミエリン空胞化自体とそれに起因する臨床症状は可逆的であり,ある程度症状が進行しても広い治療範囲が残っている可能性があります。ただし,自閉症や認知機能低下などの他の表現型は、ミエリン空胞化の影響であるかどうか不明なので,同じように可逆的であるかどうかはわかっていません。
患者数
極めて稀な病気であるため,患者数について明確な報告はありませんが,日本では20人程度と言われています。過去の症例報告では,最も大規模な研究(Hamilton et al.,2018)で,世界中の約240人の症例が紹介されています。
分類
一般に,白質ジストロフィー(Leukodystrophy)あるいは遺伝性白質脳症という大きなカテゴリーに分類されていますが,細分類として「星状細胞(アストロサイト)の疾患」に分類されます。同じカテゴリーに属する疾患として,
・アレキサンダー病(Alexander disease)
・白質消失病(Vanishing white matter disease;VWM)
・エカルディ・グティエール症候群(Aicardi Goutieres syndrome)
・ClC-2チャネル関連疾患
などが挙げられています(Lanciotti et al., 2013,van der Knaap et al., 2017)。同じカテゴリーに属する疾患の研究成果が,MLCに対しても反映できる可能性があります。
別名
最近はほぼ「Megalencephalic leukoencephalopathy with subcortical cysts; MLC」で統一されていますが,MLCが発見された当初の論文などでは,以下の表記が用いられている例もあります。
・Van der Knaap Syndrome(ファンデルナップ病,ファンデルナップ症候群)
・Vacuolating Megalencephalic Leukoencephalopathy with Subcortical Cysts
・LVM
・Leukoencephalopathy with swelling
・Vacuolating leukoencephalopathy(VL)
MLCについて説明したウェブページ
・小児慢性特定疾病情報センター
・難病情報センター
・遺伝性疾患プラス
・MLC世界患者会(Alliance MLC)
・アムステルダム自由大学_UMC(University Medical Centers)
・GeneReviews®
・ELA(European Leukodystrophies Association)
・ULF(The United Leukodystrophy Foundation)
研究グループ
MLCが1995年に発見されてから,世界各国で病態解明や治療に関する研究が進められてきました。以下に,MLCの研究を行っているグループを紹介します。
【参考】MLC世界患者会(Alliance MLC)研究者リスト
バルセロナ大学(スペイン)
Raul Estevezを中心とした研究グループです。2000年ごろから現在まで,MLCの病態解明に関する数多くの論文を発表しています。Sanchez et al.(2020)では,遺伝子治療の検討が行われています。MLC1に罹患したマウスに対し,正常な遺伝子を導入することで,症状の改善を達成したことが報告されています。
バルセロナ大学神経科学研究所(The Institute of Neurosciences)ホームページ
イタリア国立衛生研究所(Istituto Superiore di Sanita; ISS; イタリア)
Elena Ambrosiniを中心とした研究グループです。バルセロナ大学同様に,MLCに関する数多くの論文を発表しています。Lanciotti et al.(2020)では,患者由来のiPS細胞から分化した星状細胞を用いた研究が現在進行中であることが示されています。ヒトiPS細胞を用いることで,これまでより詳細な病態解明が期待されます。また,さまざまな薬の効果をin vitro(試験管内)で試すことができるため,既に承認されている薬の有効性が明らかになる可能性もあります。
ISS神経科学(Neuroscienze)部門ホームページ
アムステルダム自由大学(VU大学; オランダ)
MLCを最初に発見したvan der Knaapが所属する大学です。古典的MLCと呼ばれる「MLC1型」を発見したのち,GliamCAM変異による「MLC2A型」,「MLC2B型」を発見(Lopez-Hernandez et al.,2011)するなど,MLCのパイオニアです。Hamilton et al.(2018)では,世界中242人の患者データに基づく分析が行われており,これまでで最大規模の症例報告です。
van der Knaapは同じアストロサイト疾患である白質消失病(VWM)の発見者でもあり,VWMの研究にも注力しています。最近では,VWMの治療法に関する研究(Dooves et al., 2017,Dooves et al., 2019),iPS細胞を用いた病態解明(Leferink et al., 2019)が発表されています。
アムステルダム自由大学UMC(University Medical Centers)ホームページ
慶応義塾大学(日本)
慶応義塾大学の田中謙二先生らにより開発された多機能遺伝子改変システム(FASTシステム)を用いたMLCの病態解明(Tanaka et al.,2010,Sugio et al.,2017,Kikuchihara et al.,2018)が発表されています。
また,2023年よりMLCのAAVベクターによる遺伝子治療の研究に着手していただいています。
【新着情報】日本初 MLCの遺伝子治療に予算がつきました。(2023.04.15)
【新着情報】慶応義塾大学、田中先生、生田さんにお時間をいただきました。(2023.09.16)
【新着情報】MLC遺伝子治療開発にAMED大型予算がつきました。(2024.03.11)
東京女子医科大学(日本)
当会顧問の山本俊至先生が所属する大学です。MLCの症例報告(Shimada et al., 2014,Masuda et al.,2015,Yamamoto-Shimojima et al.,2020)が発表されています。
東京女子医科大学山本俊至先生のホームページ
北京大学
MLCの症例報告(Wang et al.,2011,Cao et al.,2016)や,病態解明(Xie et al.,2012,Shi et al.,2019)が発表されています。また,類似疾患である白質消失病(VWM)に対する患者iPSC由来のアストロサイトを用いた病態解明(Zhou et al.,2019, Deng et al.(2022))も発表されています。
韓国脳研究所(Korea Brain Research Institute;KBRI;韓国)
MLCの病態解明に関する論文(Hwang et al.,2019,Hwang et al.,2021)が発表されています。
その他にも以下のような症例報告が発表されています。
・Tsujino et al.(2003)(国立精神神経医療研究センターほか; 日本)
・Dai et al.(2017)(中南大学; 中国)
・Choi et al.(2017)(ソウル国立大学ほか; 韓国)
管理人の勉強部屋
管理人がMLCや類似疾患について勉強したメモを綴っています。主に論文レビューで,随時更新していく予定です。素人レビューのため,理解に誤りがあるかもしれませんが,ご了承ください。
※下線付き斜体で示しているところは,管理人の私見になります。
以下のカテゴリー別に整理しています。
・白質ジストロフィー概要
・MLC症例報告
・MLC病態解明
・遺伝子治療関連
・iPS細胞関連
・その他
白質ジストロフィー概要
白質ジストロフィーとは
アムステルダム自由大学UMC(University Medical Centers)HPより [Link]
-
Leukodystrophy(白質ジストロフィー) は、白質脳症のうち遺伝的欠陥によって引き起こされる疾患であり、病理学的には進行性の症状とミエリン(髄鞘)障害によって特徴づけられる。ミエリンは,脳内の信号を伝達する軸索を覆う構造体であり,グリア細胞のひとつであるオリゴデンドロサイトにより作成される。ミエリンの存在により脳内の信号伝達が円滑に行うことができるが,白質ジストロフィーでは,ミエリンに障害があるため信号伝達が円滑にいかず,様々な神経機能障害が引き起こされる。
よく似た用語にLeukoencephalopathy(白質脳症)があるが,これはより広範な定義で,白質のみ,あるいは主に白質に関与する全ての障害のことを言い,遺伝性でない後天的な疾患や,進行性でないものも含まれる。例えば,多発性硬化症や進行性多巣性白質脳症(PML)などは,白質ジストロフィーではない白質脳症である。
より詳しい情報はGene Reviews® Japan(Gene Reviews日本語翻訳サイト)に記載されている。
▼
▲
白質ジストロフィーの分類(オランダVU大学)
van der Knaap et al.(2017): Leukodystrophies: a proposed classification system based on pathological changes and pathogenetic mechanisms; Acta Neuropathol. 2017; 134(3): 351–382. ; doi: 10.1007/s00401-017-1739-1 [PMC]
-
白質ジストロフィーの分類について,これまでの多くの関連研究をレビューし総括した論文。分類のポイントとしては,①どの細胞(オリゴデンドロサイト/アストロサイト/ミクログリア/…)に起因するか,②ミエリンがどのように障害されるか(形成不全,脱髄,ミエリン空胞化)。
白質ジストロフィーの分類(論文より転載,日本語訳,日本語サイトのリンク付与)
分類 疾患名 ミエリン障害 髄鞘形成不全 ペリツェウス・メルツバッハー病(PMD;PLP1変異) 末梢神経障害、中枢性髄鞘形成不全症、ワーデンバーグ症候群、ヒルシュスプルング病(SOX10変異) ペリツェウス・メルツバッハー様疾患(Cx47変異;GJA12変異) 初期の有髄構造の髄鞘形成不全 脱髄 異染性白質ジストロフィー(MLD;ARSA変異) マルチプルサルファターゼ欠損症(SUMF1変異) グロボイド細胞白質ジストロフィー(クラッベ病;GLD;GALC変異) X連鎖副腎白質ジストロフィー(XALD;ABCD1変異) ミエリン空胞化 白質脳症を伴うミトコンドリア病 フェニルケトン尿症 カナバン病(ASPA変異) その他のアミノ酸代謝障害 Cx32関連(X連鎖)シャルコー・マリー・トゥース病 アストロサイト障害 アレキサンダー病 皮質下嚢胞を伴う巨大脳白質脳症(MLC) ClC-2関連疾患 白質消失病(VWM) エカルディ・グティエール症候群とその変種 Oculodentodigital dysplasia(ODDD) 軸索障害 基底核及び小脳萎縮を伴う髄鞘形成不全症(TUBB4変異) 先天性白内障を伴う髄鞘形成不全(FAM126A変異) 早期発症の神経変性疾患
・GM1ガングリオシドーシス,GM2ガングリオシドーシス
・神経セロイドリポフスチン症
・AGC1関連疾患
・AIMP1関連疾患
・HSPD1関連疾患Pol III関連白質ジストロフィー 脳幹および脊髄の障害と乳酸上昇を伴う白質脳症(LBSL) 脳幹および脊髄の関与および脚の痙縮を伴う髄鞘形成不全(HBSL) 巨大軸索ニューロパチー(GAN) ミクログリア障害 CSF1R関連障害
・神経軸索スフェロイド形成を伴う遺伝性びまん性白質脳症(HDLS)
・色素性または色彩性白質ジストロフィー那須・ハコラ病 血管障害 皮質下梗塞と白質脳症を伴う常染色体優性脳動脈症(CADASIL) 禿頭と変形性脊椎症を伴う常染色体劣性白質脳症(CARASIL) 脳卒中および白質脳症を伴うカテプシンA関連動脈症(CARASAL) 脳アミロイドアンギオパチー 脳石灰化と嚢胞を伴う白質脳症
▼
▲
MLC症例報告
世界242人の症例報告(オランダVU大学)
Hamilton et al.(2018): Megalencephalic leukoencephalopathy with subcortical cysts: Characterization of disease variants; Neurology. 2018 Apr 17; 90(16): e1395–e1403.; doi : 10.1212/WNL.0000000000005334 [PMC]
-
アムステルダム自由大学(VU大学)に集められた世界中242人のMLC患者(MLC1:187人,MLC2A:17人,MLC2B:38人)の臨床症状,MRI画像,遺伝子情報のデータに関する分析。臨床症状に関しては,以下のような知見が得られている。
- 患者の約90%で,大頭症(平均頭囲+2σ以上)が確認された。
- MLC1,MLC2A型の患者で,運動悪化の最初の兆候が示された年齢は,6か月から41歳の範囲で中央値は5歳。MLC2Bは運動悪化は見られず。
- MLC1の患者の約40%,MLC2Aの患者の約50%が,15歳より前に歩行能力を失った。残りの患者は,その後も歩行可能なままの場合が多い。
- 自閉症は,MLC1患者の約10%,MLC2B患者の約25%で確認された。
- 認知障害はMLC2Bの患者の4分の1で報告されたが,その後の認知機能の低下はなかった。
- MLC1,MLC2Aの患者のほぼ半数で認知機能の低下が報告された。
- MLC1,MLC2Aの患者の約75%が20歳までに1回以上の発作を起こした。最初の発作の年齢の中央値は3歳,最頻値は2歳。投薬で十分に管理できる場合が多い。MLC2Bの患者では発作はあまり多くはなかった。
- 遺伝子変異のタイプと症状の相関はなかった。
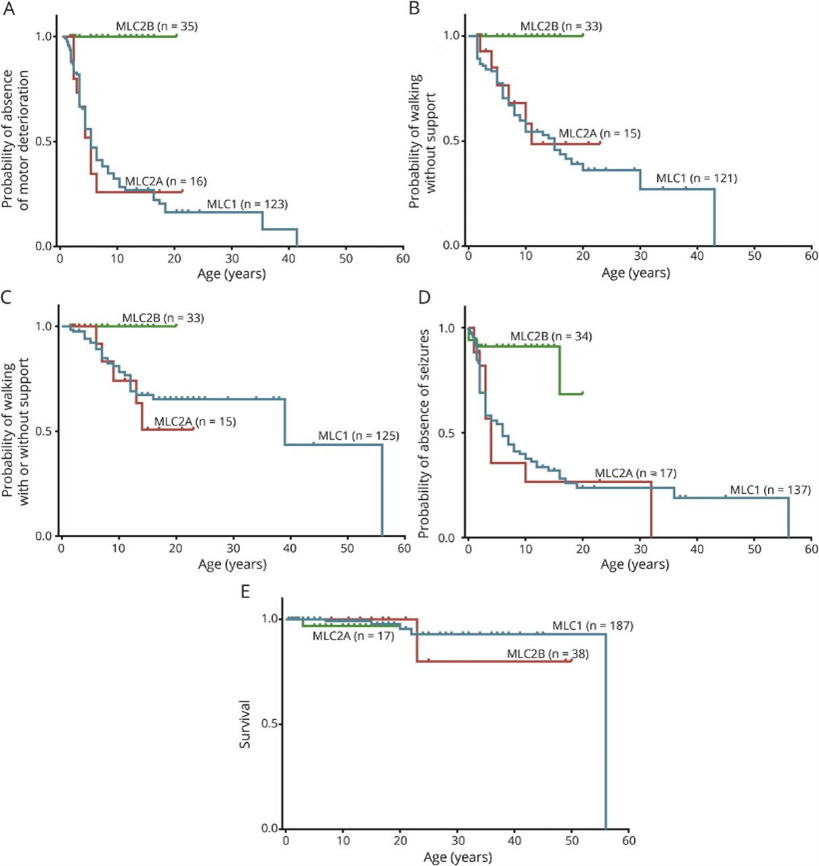
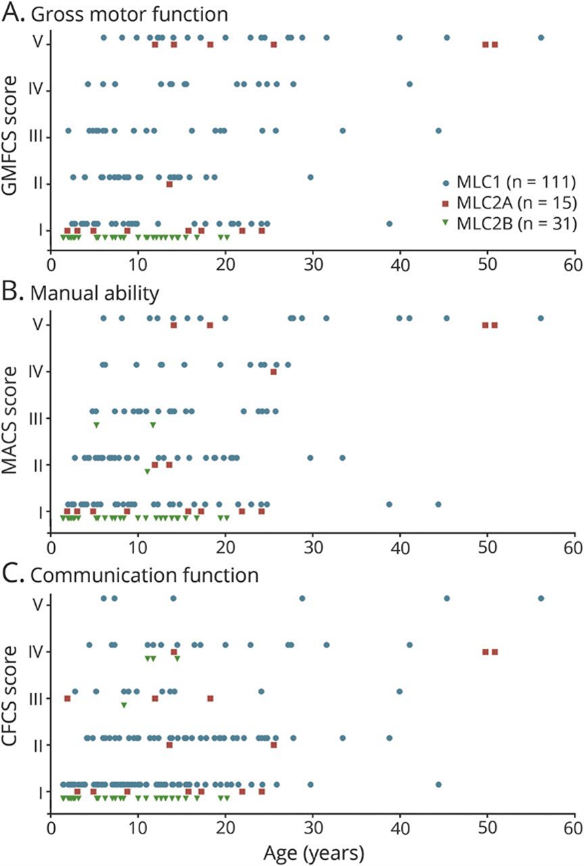
患者年齢と臨床症状との関係(論文より転載)
▼
▲
中国27人の症例報告(北京大学)
Wang et al.(2011): Identification of novel MLC1 mutations in Chinese patients with megalencephalic leukoencephalopathy with subcortical cysts (MLC); Journal of Human Genetics volume 56, pages138–142 (2011); doi : 10.1038/jhg.2010.146
Cao et al.(2016): Ten Novel Mutations in Chinese Patients with Megalencephalic Leukoencephalopathy with Subcortical Cysts and a Long-Term Follow-Up Research; PLoS One. 2016; 11(6): e0157258.; doi : 10.1371/journal.pone.0157258 [PMC]
-
中国の北京大学による症例報告。中国の27人(1歳~13歳)のMLC患者の臨床症状,MRI画像,遺伝子情報のデータに関する分析が行われ,臨床症状に関しては,以下のような知見が得られている。
- 頭囲は出生後~1歳で急速に増加し,その後は平均頭位より数センチ大きい状態で維持(増加率は正常化する)されることが多い。
- 運動機能発達遅延は22人(81.5%)の患者で見られた。また運動機能の低下は5人(18.5%)の患者で見られた。
- 認知機能発達遅延は5人(18.5%)の患者で見られ,認知機能の低下は2人の患者(7.4%)で見られた。
- 歩行能力喪失は2人の患者で確認された。麻痺,構音障害,嚥下障害は1人の患者で確認された。
- 軽度の頭部外傷や発熱を契機とした,発作や一過性の運動後退が見られた。発熱よりも頭部外傷の方が,これらを引き起こす例が多かった。
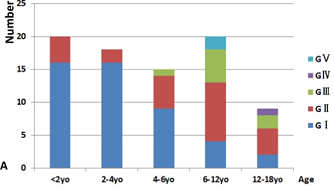
各年齢における運動能力(GMFCS)の分類(論文より転載)
▼
▲
MLC病態解明
新しい変異遺伝子AQP4,GPRC5Bの発見(VU大学)
Passchier et al.(2023): Aquaporin-4 and GPRC5B: old and new players in controlling brain oedema; Brain. Aug 1;146(8):3444-3454. doi: 10.1093/brain/awad146.
-
VU大学の研究グループによる論文。臨床的特徴とMRIによってMLCと診断された患者のうち,MLC1またはGLIALCAM変異も持たない患者に対して新規遺伝子変異体を特定するために遺伝子研究を実施し,新たにAQP4,GPRC5Bという遺伝子が発見されたことが報告されている。
▼
▲
MLCの病態と治療に関するこれまでの研究総括(バルセロナ大学)
Bosch et al.(2021): Megalencephalic Leukoencephalopathy: Insights Into Pathophysiology and Perspectives for Therapy; Front. Cell. Neurosci., 22 January 2021; doi : 10.3389/fncel.2020.627887
-
バルセロナ大の研究グループによるレビュー論文。これまで行われてきたMLCのほとんどの研究がレビューされているので,2021年時点での病態解明の現状が概ね把握できる。
MLCと関連の深いタンパクとして,MLC1,GlialCAM,ClC-2,Na+/K+ATPアーゼ,そのほかのATPアーゼ(PMCA1,2,3,SERCA1,2,V-ATPアーゼ),VRAC チャネル(LRRC8A),Cx43,TRPV4,Kir4.1,AQP4などが挙げられている。
これまで20年近くの研究で,MLC病態に関する知見はかなり蓄積されているように思われるが,バルセロナ大学は,まだまだMLCについて未知のメカニズムが多く残っているため,MLC1/GlialCAMを直接修正する遺伝子治療のアプローチが最も現実的と考えている印象。
▼
▲
アストロサイト疾患におけるグリア細胞の相互作用(オランダVU大学)
deWaard et al.(2020): Astrocyte–Oligodendrocyte–Microglia Crosstalk in Astrocytopathies, Front. Cell. Neurosci., 19 November 2020; doi ; 10.3389/fncel.2020.608073 [PMC]
-
VU大学による報告。van der knaapは共著者に入っていないが,同じVU大学UMCに所属している研究者による報告である。「アストロサイト疾患」として分類される「白質消失病(VWM)」、「アレキサンダー病(AxD)」、「MLC」、「ClC-2関連疾患」、「エカルディ・グティエール症候群(AGS)」,「眼球歯状突起異形成症(ODDD)」に関する最新の知見を,既往研究のレビューによりまとめている。
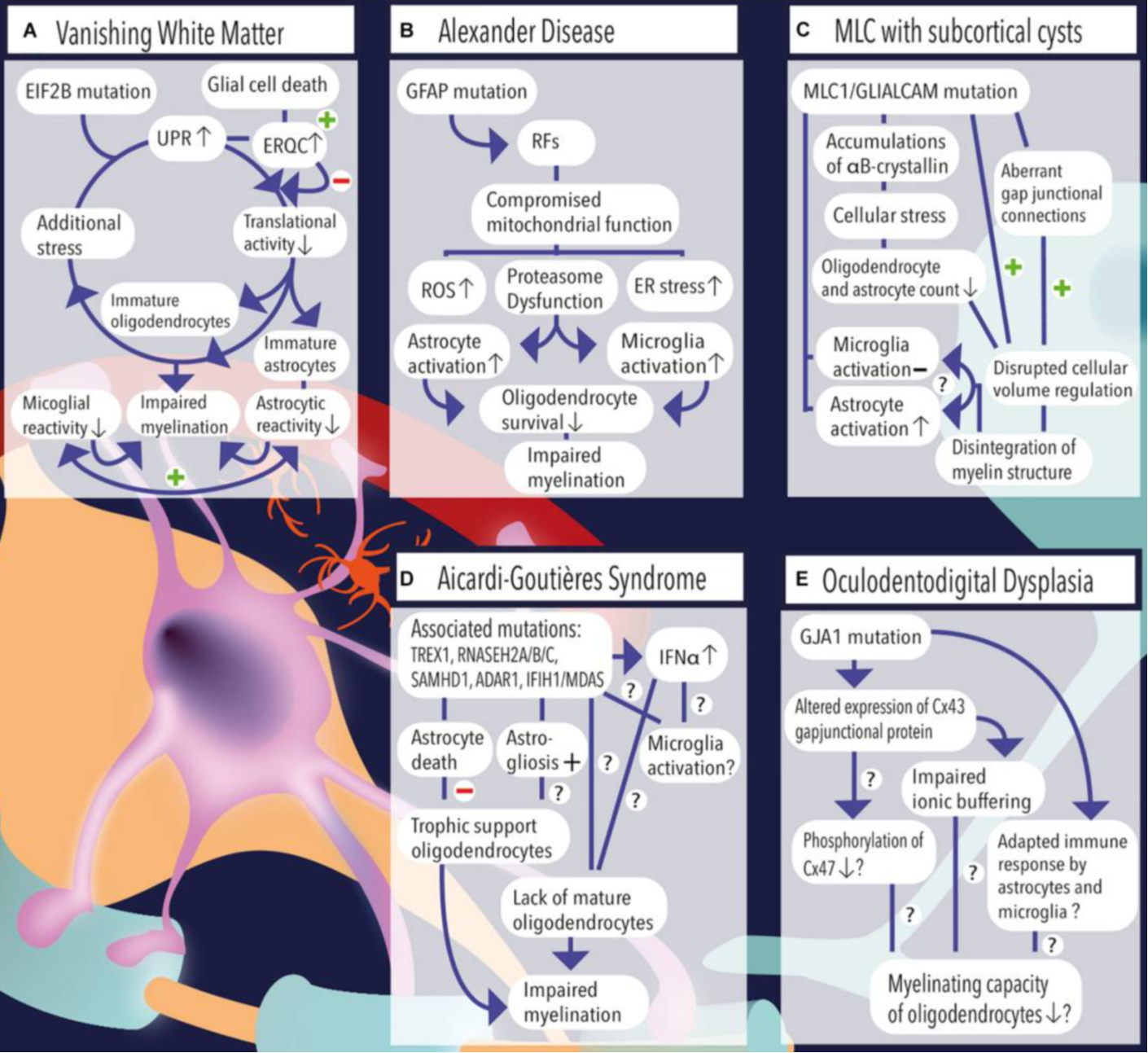
それぞれのアストロサイト疾患のメカニズム(論文より転載)
それぞれのアストロサイト疾患の概要
疾患 グリア細胞 病態 ハイライト 白質消失病 ■アストロサイト
・皮質下U線維の星状細胞数の減少
・未成熟で非活性化された表現型:幅広い鈍いプロセス
・アストログリオーシスは見られない
■オリゴデンドロサイト
・OPC(オリゴデンドロサイト前駆細胞)に対する成熟オリゴデンドロサイト比の増加
■ミクログリア
・ミクログリオーシスは見られない・ミエリンの菲薄化,欠如,空胞化、組織の希薄化とキャビテーション
・グリアUPR(小胞体ストレス応答)の活性化の上昇
・細胞骨格の欠陥・ミトコンドリア機能の欠陥(酸化的リン酸化の低下)
・ECM分子(ヒアルロン酸)の組成の変化
・アストロサイトとミクログリアの炎症反応の低下
・オリゴデンドロサイト成熟欠陥アレキサンダー病 ■アストロサイト
・アストロサイト数は変化なし
・活性化された表現型と細胞質基質におけるローゼンタール線維の存在
・アストログリオーシス++
■オリゴデンドロサイト
・OPCの成熟停止
・成熟度の低いオリゴデンドロサイト
・細胞外環境におけるイオン緩衝の欠陥によるオリゴデンドロサイト生存率の低下
■ミクログリア
・ミクログリオーシス++・ミエリンの欠如または喪失
・ミトコンドリア機能の低下
・細胞の酸化ストレスのレベルの上昇・プロテアソーム機能障害
・小胞体ストレス→グリア細胞反応性への寄与
・細胞外環境におけるイオンバランスの制御障害
・ECM分子(ヒアルロン酸およびCHI3L1)の組成の変化MLC ■アストロサイト
・アストロサイトの減少
・細胞の体積調節の乱れによる膨張
・アストログリオーシス+
■オリゴデンドロサイト
・オリゴデンドロサイトの減少
■ミクログリア
・ミクログリオーシスは見られない・大脳白質の空胞化
・ミエリンの量は変化なし
・イオン-水恒常性の調節不全・ギャップ結合の変化 エカルディ・グディエール症候群 ■アストロサイト
・アストロサイトの減少
・アストログリオーシス+
■オリゴデンドロサイト
・OPCに対する成熟オリゴデンドロサイト比の増加
・オリゴデンドロサイトアポトーシス(細胞死)率の増加
■ミクログリア
・ミクログリオーシス±・ミエリンの欠如
・IFNα(インターフェロンα)レベルの増加と制御不全
・頭蓋内石灰化ならびに小血管壁の石灰化、重度の小頭症、ミエリンの欠如、皮質微小梗塞、組織の炎症眼球歯状突起異形成 不明 ・Cx43の発現の低下→ギャップ結合の変化
・アストロサイトとミクログリアによる免疫応答の制御不全
筆者が結論で述べていたが,MLCあるいはGlialCAM変異の影響を受けるタンパク質は上述した通りいろいろあるが,その中では,Cx43の障害によるアストロサイト同士のギャップ結合の障害の影響が比較的大きそうな印象。Lanciotti et al(2020)では,Cx43とERK伝達経路との関連が示唆されていたので,ここを標的とした治療アプローチは有効かもしれない。
▼
▲
MLC1がCx43へ与える影響について(イタリアISS)
Lanciotti et al.(2020): Megalencephalic Leukoencephalopathy with Subcortical Cysts Disease-Linked MLC1 Protein Favors Gap-Junction Intercellular Communication by Regulating Connexin 43 Trafficking in Astrocytes; Cells 2020, 9(6), 1425; doi : 10.3390/cells9061425 [PMC]
-
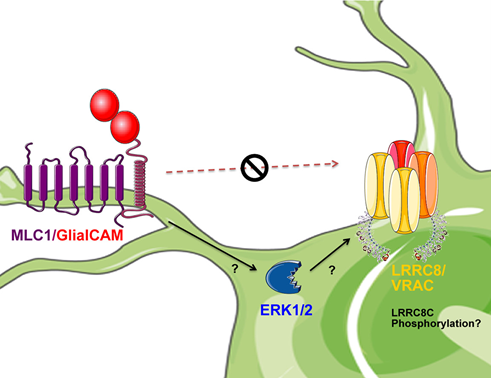
イタリアISSの研究グループによる報告。正常なMLC1タンパクが,シグナル伝達分子のひとつであるERKを介したCx43のリン酸化を抑え、Cx43ギャップ結合の安定性を高めることによって細胞間のコミュニケーションを促進することを明らかにした研究。
ERKが体積調節チャネル(VRAC)のLRRC8Cサブユニットにも影響を与えること(Elorza-Vidal et al.,2018)や,Cx43ギャップ結合の欠陥がK+イオンの調節不全につながることを示した過去の知見も踏まえ,ERKを標的とした治療法の有効性が示唆されている。
また,Cx43が出生後の血液脳関門 (BBB)成熟プロセスにおいて必要な役割を担う(Gilbert A, et al., 2018)ことから,MLC患者において出生後早期に現れる症状である巨頭症が, MLC1変異によるCx43異常に起因している可能性が示唆されている。
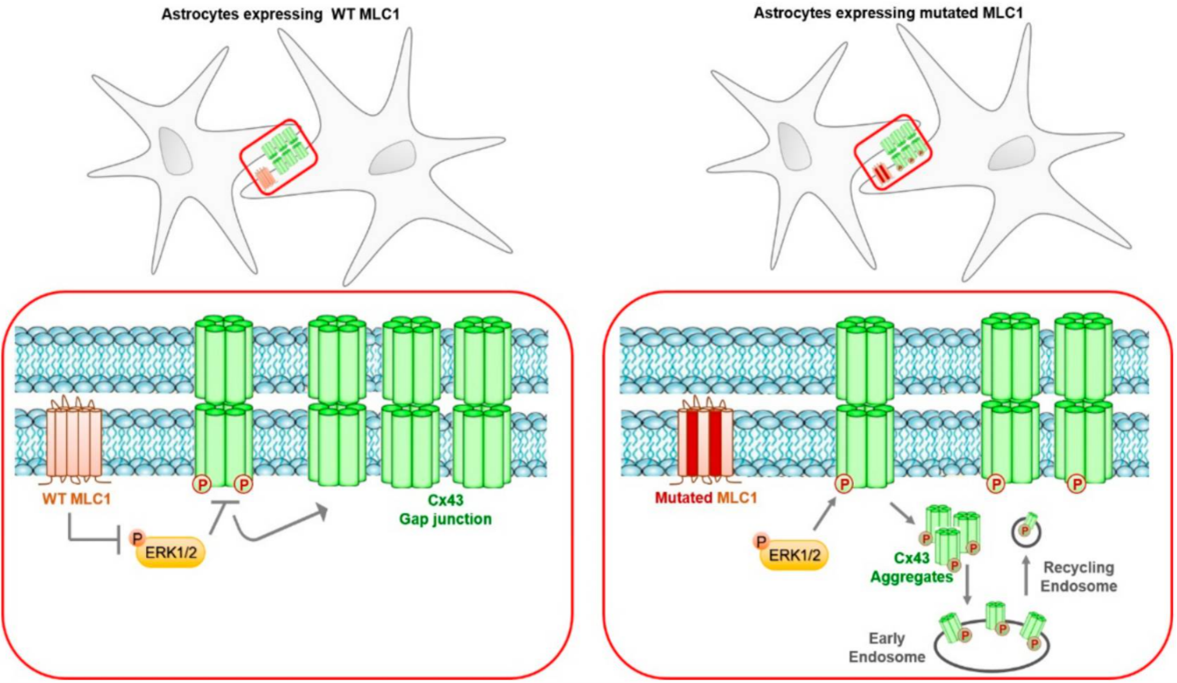
アストロサイトにおけるMLC1を介したCx43調節メカニズムの概略図(論文より転載)
この論文中に,患者由来のiPS細胞から分化した星状細胞を用いた研究が現在進行中であることが示されている。この件について,ISSのホームページに記載があった(2021年8月現在)。このホームページでは,以下のことが示されている。
・MLC1は、特定の細胞内シグナル伝達分子(EGFR、ERK、NF-kB、STAT3)の調節を通じて、イオンおよび水交換に関与する多数のタンパク質(イオンチャネル/ポンプ、水チャネル)の機能に影響を与える。
・MLC1の病理学的変異は、これらのシグナル伝達経路を変化させることにより、異常な腫れ、細胞ストレス、増殖の活性化など、星状細胞で観察される機能障害を引き起こす。
・上記分子は、細胞内シグナル伝達経路の正しい機能を回復するために薬理学的に調整できることを考えると、MLCに有効な治療法を特定できる可能性がある。
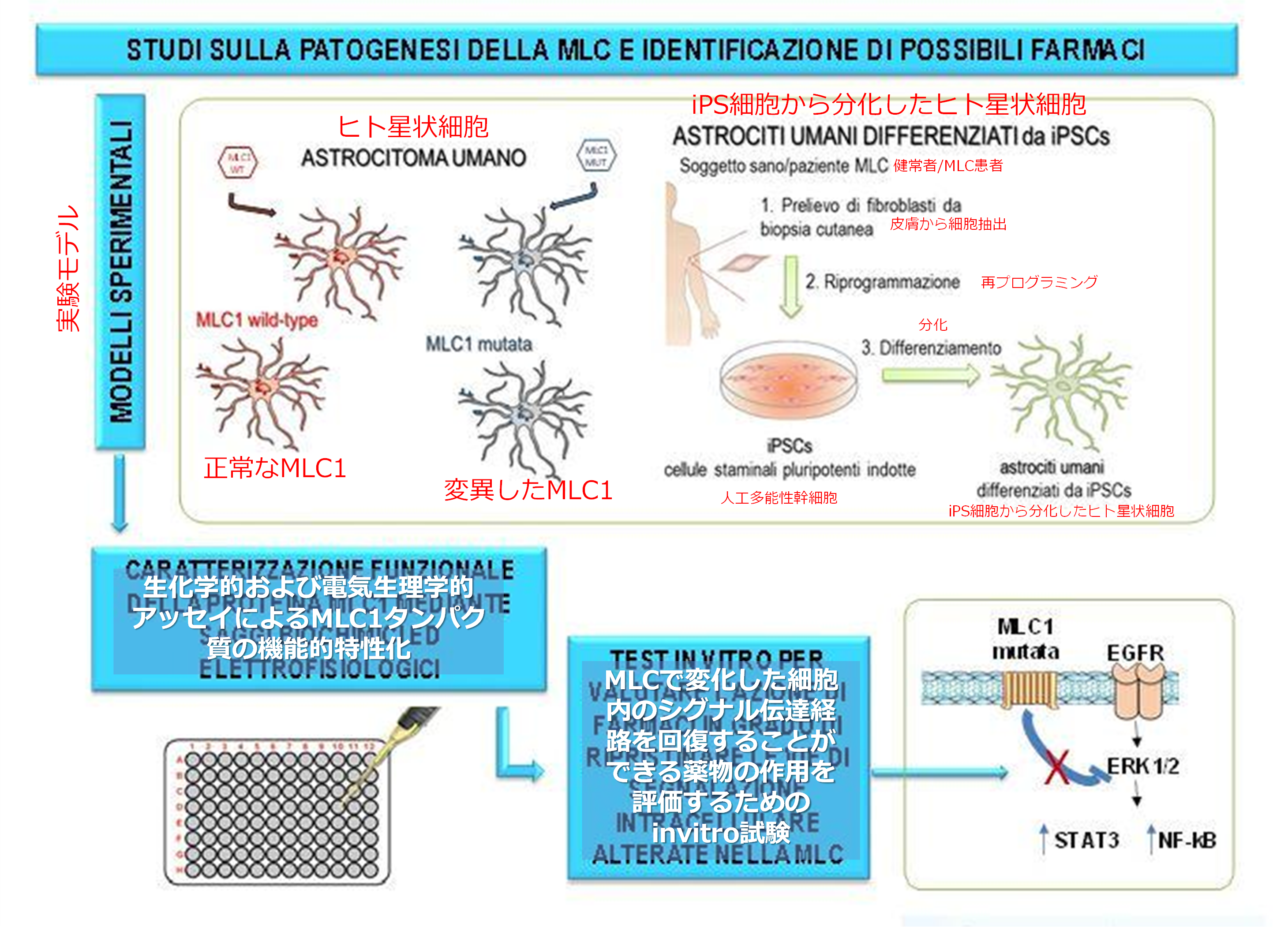
iPS細胞を用いた研究の模式図(ISSのホームページより転載・日本語加筆)
バルセロナ大学が進めている遺伝子治療のように根本的な治療ではないかもしれないが,シグナル伝達経路を標的とした分子標的薬はがんの治療薬として既に承認された薬が多くあるので,遺伝子治療より早く治療法が確立される可能性が期待できる。
▼
▲
GlialCAM/MLC1のVRACチャネルに対する制御(バルセロナ大学とイタリアISS)
Elorza-Vidal et al.(2018): GlialCAM/MLC1 modulates LRRC8/VRAC currents in an indirect manner: Implications for megalencephalic leukoencephalopathy; Neurobiology of Disease
Volume 119, November 2018, Pages 88-99; doi : 10.1016/j.nbd.2018.07.031
MLC1のEGFRシグナル伝達に対する制御(イタリアISS)
Lanciotti et al.(2016): Megalencephalic leukoencephalopathy with subcortical cysts protein-1 regulates epidermal growth factor receptor signaling in astrocytes; Human Molecular Genetics, Volume 25, Issue 8, 15 April 2016, Pages 1543–1558; doi : 10.1093/hmg/ddw032
-
イタリアISSの研究グループによる,MLC1変異が,シグナル伝達分子のひとつである上皮成長因子受容体(EGFR)の働きに影響を与えることを明らかにした研究。EGFRはアストロサイトなどの細胞を増殖する働きがあり,MLC1はその過剰な活性化を抑える機能がある。MLC1変異はその制御機構がうまく働かないため,細胞増殖が過剰になる。
上記EGFR調整不全は,がんで腫瘍が増殖する要因のひとつである。しかし,MLC患者において脳腫瘍の発生率が増加したという報告は今のところないため,他の要因が腫瘍形成につながる複雑なイベントに関与していることが論文中で示唆されている。また,MLC1同様にEGFR調節不全をもたらす常染色体優性多発性嚢胞腎(ADPKD)という疾患において,EGFRチロシンキナーゼ活性を阻害したところ症状が改善した例(Wilson S.J. et al., 2006)が示されている。
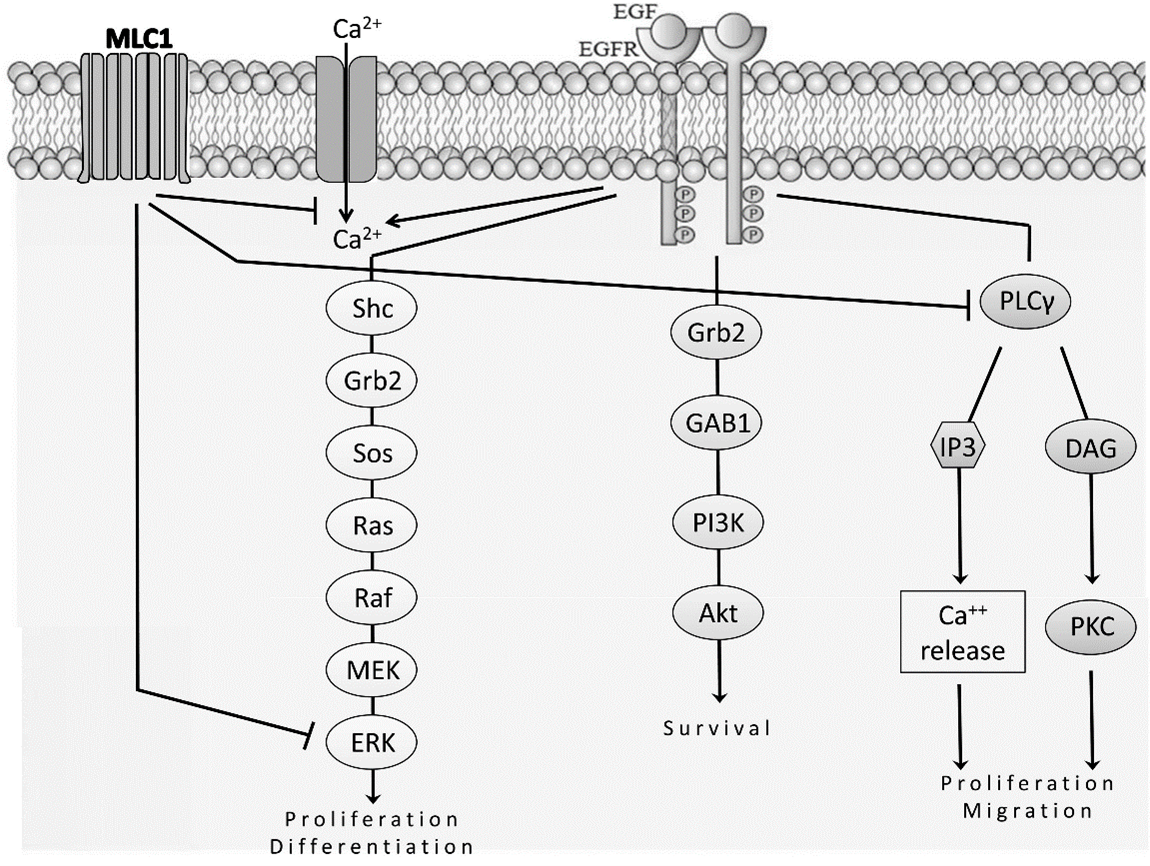
ヒトU251星状細胞腫細胞においてMLC1によって阻害されるEGFR活性化経路の概略図(論文より転載)
EGFRチロシンキナーゼ阻害薬などのがんの治療法がMLC1の治療に応用できるかもしれない。
▼
▲
チャネロパチーとしてのMLC(イタリアISS)
Brignone et al.(2015): MLC1 protein: a likely link between leukodystrophies and brain channelopathies; Front Cell Neurosci. 2015; 9: 66.; doi : 10.3389/fncel.2015.00106 [PMC]
-
イタリアISSの研究グループによるMLCのメカニズムに関する研究。MLC1変異の影響を,脳のチャネロパチー(イオンチャネルサブユニットまたはそれらを調節するタンパク質の機能の変化によって引き起こされる遺伝的または後天性の疾患)に関連付けられることが示されている(参考:チャネロパチー概論)。
MLC1と相互作用するタンパク質として,下図に示すタンパク質が挙げられている。
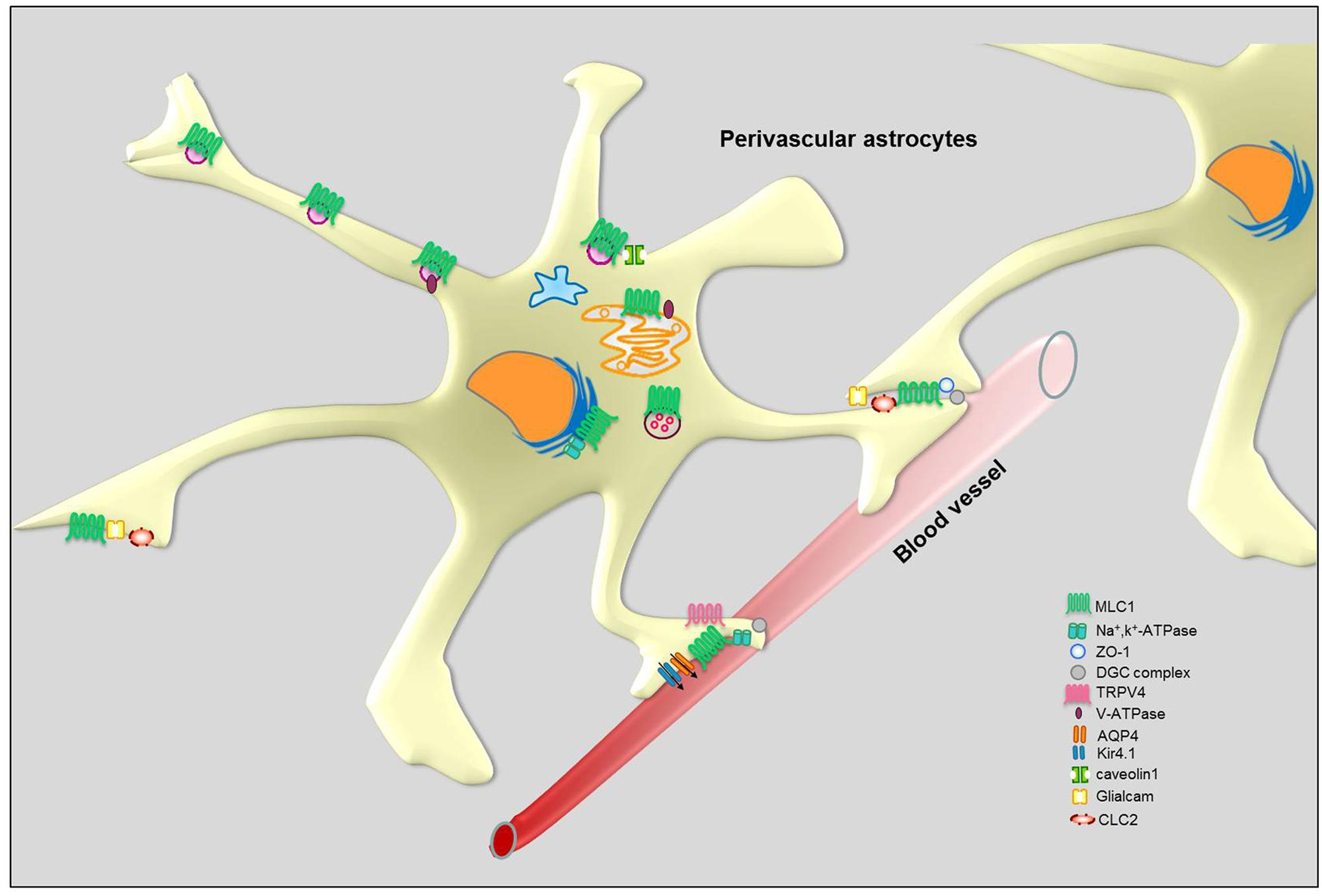
血管周囲星状細胞におけるMLC1分子相互作用の概略図(論文より転載)
▼
▲
ClC-2との相互作用について(バルセロナ大学)
Hoegg-Beiler et al.(2014): Disrupting MLC1 and GlialCAM and ClC-2 interactions in leukodystrophy entails glial chloride channel dysfunction; Nat Commun
. 2014 Mar 19;5:3475. doi : 10.1038/ncomms4475
-
バルセロナ大学の研究グループによるMLCのメカニズムに関する研究。MLC1、GlialCAMと,ClC-2と呼ばれる塩素チャネルの役割や相互作用について調査している。MLC1,GlialCAMの変異により,ClC-2の局在や電流に変化をもたらし,白質ジストロフィーの症状を引き起こすことが示されている。ただし,MLC1,GlialCAMの変異がClC-2以外への影響があることも示唆している。
▼
▲
アストロサイト障害に起因する白質ジストロフィー(イタリアISS)
Lanciotti et al.(2013): Astrocytes: Emerging stars in leukodystrophy pathogenesis; Transl Neurosci. 2013 Jun 1; 4(2); doi : 10.2478/s13380-013-0118-1 [PMC]
-
イタリアISSの研究グループによる,アストロサイト障害に起因する白質ジストロフィーに関するレビュー論文。MLCがアストロサイトの障害に起因することが示されている。アストロサイトの障害による白質ジストロフィーとして,アレキサンダー病,白質消失病,MLCが同じカテゴリーとのこと。
アストロサイトに障害があると、さまざまな種類の病的傷害やストレス状態によって引き起こされる組織の恒常性の変化に対して脳がより脆弱になり、組織の損傷が悪化する可能性があるとして,頭部外傷や発熱のリスクを説明している。
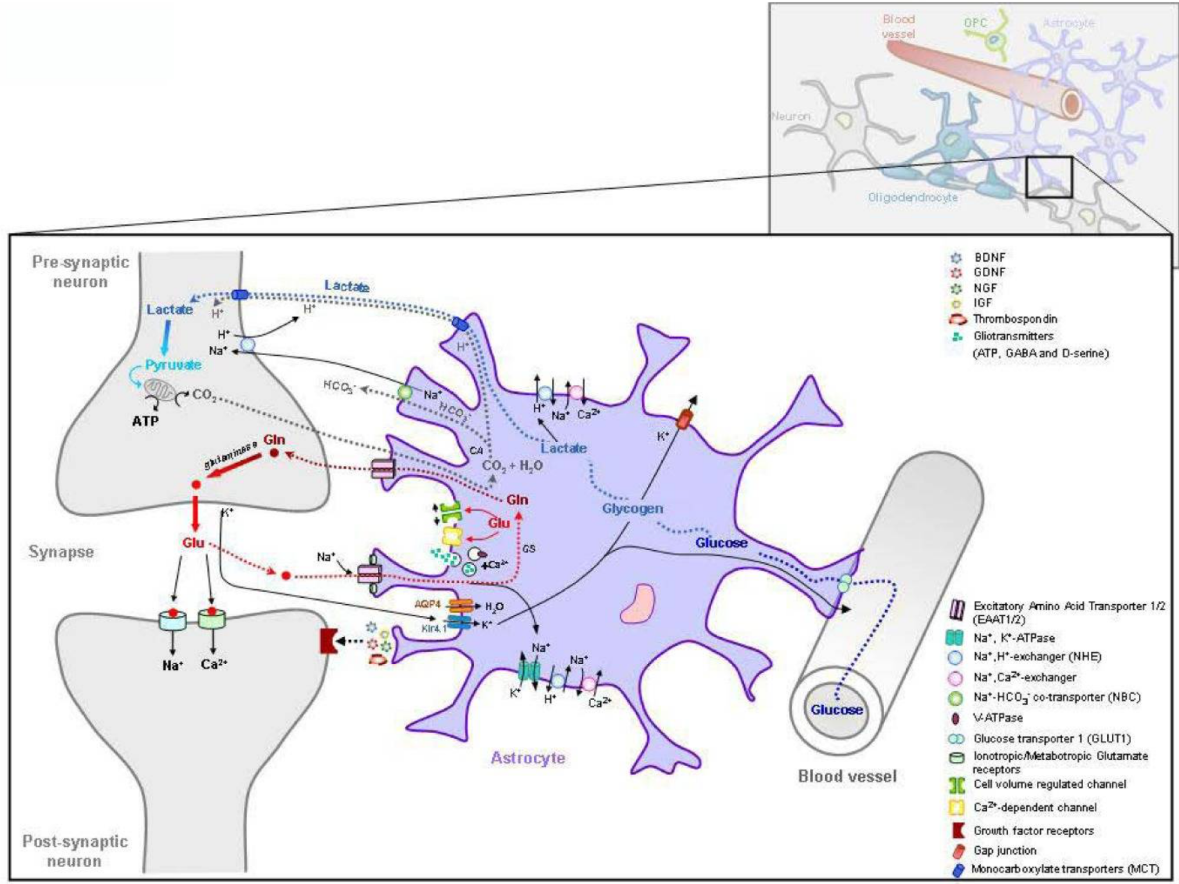
アストロサイトとニューロンの関係(論文より転載)
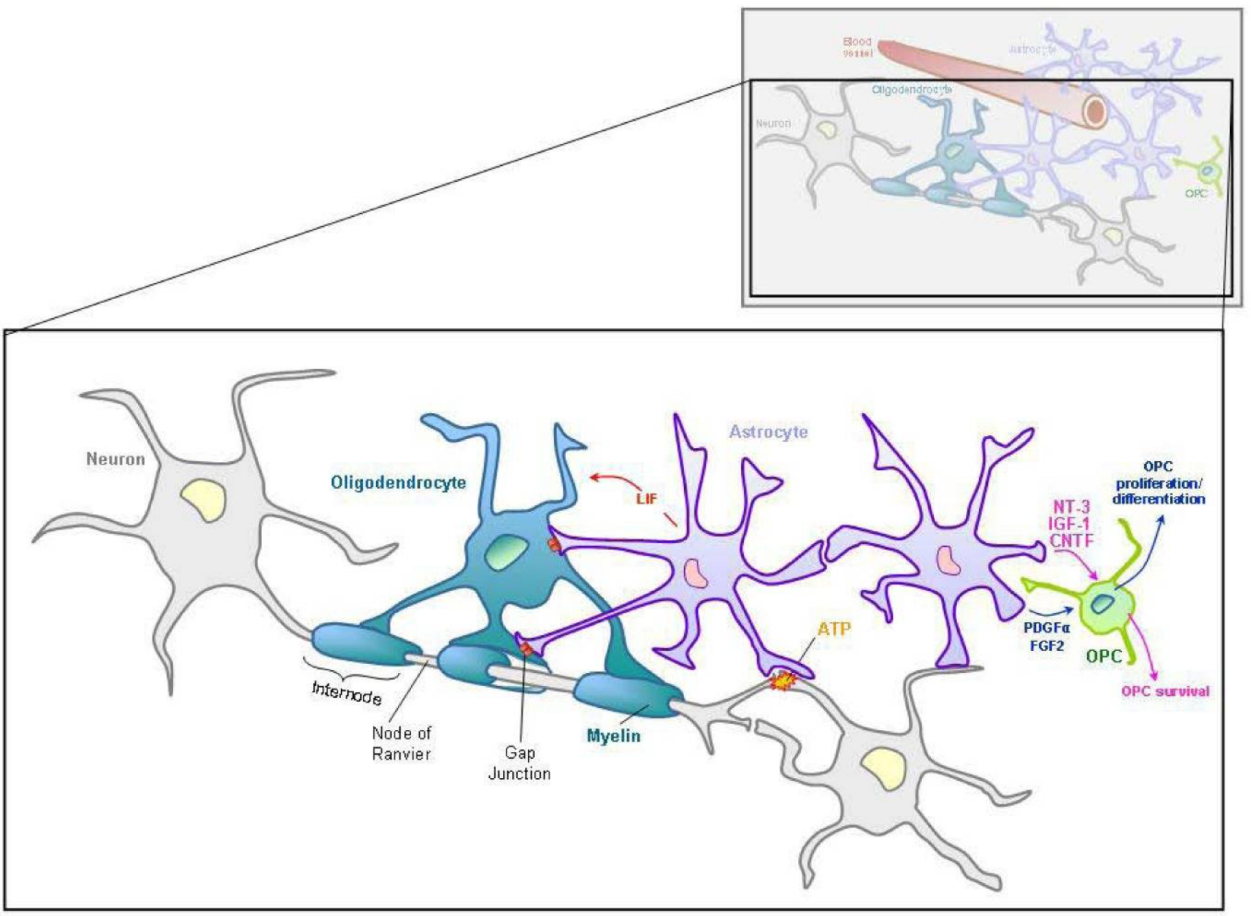
アストロサイトとオリゴデンドロサイトおよびミエリンとの関係(論文より転載)
▼
▲
遺伝子治療関連
白質ジストロフィーを対象とした遺伝子治療総括
Jonquieres et al.(2021): Emerging Concepts in Vector Development for Glial Gene Therapy: Implications for Leukodystrophies; Front. Cell. Neurosci., 22 June 2021 ; doi: 10.3389/fncel.2021.661857 [PMC]
-
これまで行われた白質ジストロフィーを対象とした遺伝子治療に関するレビュー論文。AAVベクターによる遺伝子導入が話題の中心ではあるが,その他の手法(造血幹細胞移植など)についても網羅的にレビューされている。
■遺伝子治療の種類
・造血幹細胞移植(hematopoietic stem cell transplantation; HSCT)
骨髄中に存在し,様々な細胞へ分化する能力を持った造血幹細胞を移植する治療方法。患者に対し,健常人ドナーから採取した造血幹細胞を移植(他家移植)することで,正常な細胞に置換する。よく耳にする骨髄移植とほぼ同義であるが,厳密には,造血幹細胞は,末梢血や臍帯血など、骨髄以外にも入手方法が多様化しているので、造血幹細胞移植のひとつとして骨髄移植があるという位置づけである。
他家移植による造血幹細胞移植は,遺伝子治療のはしりとなる技術で,白質ジストロフィーでは,X連鎖副腎白質ジストロフィー(ALD)、異染性白質ジストロフィー(MLD)、クラッベ病などに対する実績がある(Musolino et al.,2014 ; Page et al.,2019)。課題として,提供元のドナーと患者とのHLA(白血球の型)が適合していない場合には,免疫不全による重度の感染症などを起こすリスクが高まる。なかなかHLAが完全に適合するドナーを探すのは難しいのが現状のようで,部分的に適合したドナーからの移植により,移植後に弊害が生じたケースも多く報告されている。
・自家移植による造血幹細胞移植(HSC-GT)
上記の他家移植におけるリスクを踏まえた代替法であり,患者自身の造血幹細胞を採取・培養し、遺伝子変異を体外で修正し再注入する手法。実績は多くないが,本人の細胞なので,HLA不適合による免疫不全などのリスクは少ないメリットがある。ALD,MLDなどで実績がある。
・その他の細胞ベースの治療法
患者由来のiPSCを遺伝子修正して患者に戻す手法(Feng et al.,2020)や,グリア前駆細胞(glial-restricted precursors;hGRP)移植(PMDの例:Uchida et al.,2000,Cummings et al.,2005, Uchida et al.,2012,Gupta et al.,2012, Gupta et al.,2019,低髄鞘化マウスの例:Windrem et al.,2008,Windrem et al.,2014,Stanaszek et al.,2021,VWMの例:Dooves et al.,2019,クラッベ病-ES細胞より分化したグリア前駆細胞移植の例:Kuai et al.,2015)など新たな細胞ベースの治療法も開発されている。
・in vivo遺伝子治療(治療用核酸をウィルスベクターにより送達する手法)
ベクター(遺伝子の運び屋)を用いて,体内に正常な遺伝子を導入する手法。これまで,アデノウィルス,レンチウィルス(LV),レトロウィルス(RV)など様々なウィルスベクターが検討されてきたが,近年では,アデノ随伴ベクター(AAV)が主流となっている。AAVは,他のベクターと比較して,安全性,形質導入効率、汎用性,生産しやすさなどが優れているらしい。
グリア細胞の遺伝子変異に起因する疾患に対する治療アプローチの検討も数多くあり,標的となる細胞へより効率的に遺伝子送達するために,AAV自体も進化している。また,プロモーターと呼ばれる情報をベクターに乗せることで,特定の細胞で特異的に発現されるようにする技術も開発されている。
・ASO(アンチセンスオリゴヌクレオチド)遺伝子治療
(勉強中)
■白質ジストロフィーの遺伝子治療研究事例
論文で紹介された遺伝子治療研究事例を下表に示す。一部,論文で紹介されていないが管理人が見つけた事例も追記している(今後も重要そうな事例を見つけたら適宜追記する)。
<疾患凡例>
PMD:ペリツェウス・メルツバッハー病(PLP1遺伝子変異)
PMLD:ペリツェウス・メルツバッハー様疾患(GJC2遺伝子変異)
CD:カナバン病(ASPA遺伝子変異)
MLD:異染性白質ジストロフィー(ARSA遺伝子変異)
GLD:球形細胞白質ジストロフィー(クラッベ病;GALC遺伝子変異)
AxD:アレキサンダー病(GFAP遺伝子変異)
VWM:白質消失病(EIB-5F遺伝子変異)
ALD:副腎白質ジストロフィー(ABCD1遺伝子変異)白質ジストロフィーの遺伝子治療研究事例
疾患 手法 出典・内容 PMD グリア前駆細胞移植 Cummings et al.(2005), Uchida et al.(2012)などでマウスによる前臨床研究が行われ,2009年に臨床試験(NCT01005004)が開始,Gupta et al.(2012),Gupta et al.(2019)などで結果に関する報告が行われている。移植された宿主の白質におけるドナー由来ミエリンの生着および限局性産生を示したが、患者の半数で免疫応答およびドナー特異的HLA同種抗体を検出した。 invivo遺伝子導入(AAV) Li et al.(2019)。国立神経精神医学センターの井上健先生らのグループによる研究。 グリア前駆細胞移植 Windrem et al.(2008),Stanaszek et al.(2021)など。 ASO Elitt et al.(2021)。マウスに対するASO治療。 PMLD invivo遺伝子導入(AAV) Georgiou et al.(2017) CD invivo遺伝子導入(AAV) McPhee et al.(2005)。rAAV2による遺伝子送達。疾患の表現型を効果的に救済することはできず。 Ahmed et al.(2013)。hASPAを遍在的に発現するrAAV9の単回静脈内注射。KOマウスの重度の神経表現型の部分的救済を達成。 Gessler et al.(2017)。アストロサイトを標的とした治療。オリゴデンドロサイトの直接治療は治療の成功に必要ではなく、アストロサイトがN-アセチルアスパラギン酸(ASPAタンパクが分解すべき物質)代謝において重要な役割を果たすことを示している。 Jonquieres et al.(2018)。 Francis et al.(2016),Francis et al.(2021)。2021年に臨床試験(NCT04833907)が開始。 患者由来iPSC移植 Feng et al.,2020。患者由来iPSCをex vivoで遺伝子修正し,患者に再導入する治療法。HSC-GTのiPSCバージョンというイメージ。この研究では,前臨床的検討として,CDに罹患したマウスに注入し,症状の改善を確認している。研究グループはアレキサンダー病のiPSCによる病態解明を行っていたベックマン研究所のグループ。1疾患に拘らずプラットフォーム技術の開発に注力している印象。 MLD HSCT Boucher etal .,2015 HSC-GT Biffi et al.(2006),Biffi et al.(2008),Biffi et al.(2013)など。2010年臨床試験(NCT01560182)が開始。Sessa et al.,2016,Fumagalli et al.(2022)などで上記臨床試験結果の報告が行われ,ヨーロッパでLibmeldyという医薬品が承認された。Libmeldyの有効性は,MLDの若年性後期変異体を対象とした臨床試験(NCT04283227)でさらに研究されている。 invivo遺伝子導入(AAV) マウス前臨床研究:Sevin et al.(2006),Sevin et al.(2007),Piguet et al.(2012),霊長類前臨床研究:Colle et al(2010),Rosenberg et al.(2014),Zerah et al(2015)。2014年臨床試験(NCT01801709)が開始。脳内のARSA活性の長期的な回復にもかかわらず,治療による予防及び安定化は達成できず(Sevin et al.,2021)。 invivo遺伝子導入(LV) 深セン免疫研究所(中国)。レンチウィルスベクターによる遺伝子送達。2018年に臨床試験(NCT03725670)が開始。論文は無い。 GLD HSCT Escolar et al.(2005)。1998年8月から2004年8月の間に造血間細胞移植を受けた患者の報告 Wright et al.(2017)。2000年1月から2011年9月に造血幹細胞移植を受けた患者の報告。 invivo遺伝子導入(AAV) Marshall et al.(2018) Pan et al.(2019) イヌ前臨床研究(クラッベ病は犬の遺伝性疾患でもあり,自然発生的に罹患した犬が存在した模様):Bradbury et al.(2018), Bradbury et al.(2020)。2021年に臨床試験(NCT04693598)が開始。 Karumuthil-Melethil et al.(2016)。AAV9、AAVrh10、AAV-Olig001のベクター比較(マウス対象)。 HSCT+invivo遺伝子導入(AAV) Rafi et al.(2020)。造血幹細胞移植とAAVによる遺伝子導入を組み合わせた手法。 HSC-GT Ungari et al.(2015)。レンチウィルスベクターの最適化に関する研究。 AxD ASO Hagemann et al.(2018),Hagemann et al.(2021)(国立神経精神医学センターの井上健先生のレビュー)。2021年に臨床試験(NCT04849741)が開始。 MLC invivo遺伝子導入(AAV) Sánchez et al.(2020)。下で別途レビューしている。 VWM グリア前駆細胞移植 Dooves et al.(2019)。下で別途レビューしている。 ALD HSCT Matsukawa et al.(2020)。成人発症型ALD HSC-GT Cartier et al.(2009)。CD34+造血幹細胞を体外で遺伝子修正し,再注入する自家移植。適合ドナーがいない2人のALD患者で実施され,いずれも細胞の注入後14〜16か月で、進行性脳脱髄が停止したと報告されている。 HSC-GT Eichler et al.(2017)。2013年10月~2015年7月に行われた4歳~13歳までの合計17人の患者に対する臨床試験(NCT01896102)の報告。治療後12~18か月経過後に効果が出てくるとのこと。これは,元のミクログリアが細胞死→移植細胞に置換のプロセスがそれくらいの期間と示唆されている。この研究の最新の報告(Kühl et al.,2020)によると、登録された32人の患者のうち31人で疾患の進行が安定し、15人の患者全員が2年間で主要な機能障害が無かったとのこと。 白質ジストロフィーでは,PMD,カナバン病,クラッベ病,MLD,ALDあたりが遺伝子治療の研究が進んでいる印象。MLCは,Sánchez et al.(2020)よる前臨床研究でAAV遺伝子治療の効果が示されているので,AAV遺伝子治療で先行しているカナバン病,クラッベ病,MLDの研究が参考になるかもしれない。一方で,アストロサイト疾患においてはアレキサンダー病,VWMともにAAV遺伝子治療の研究は行われていないので,アストロサイトを標的とした効果的な遺伝子送達のノウハウについては,まだ知見が少ないと思われる。
▼
▲
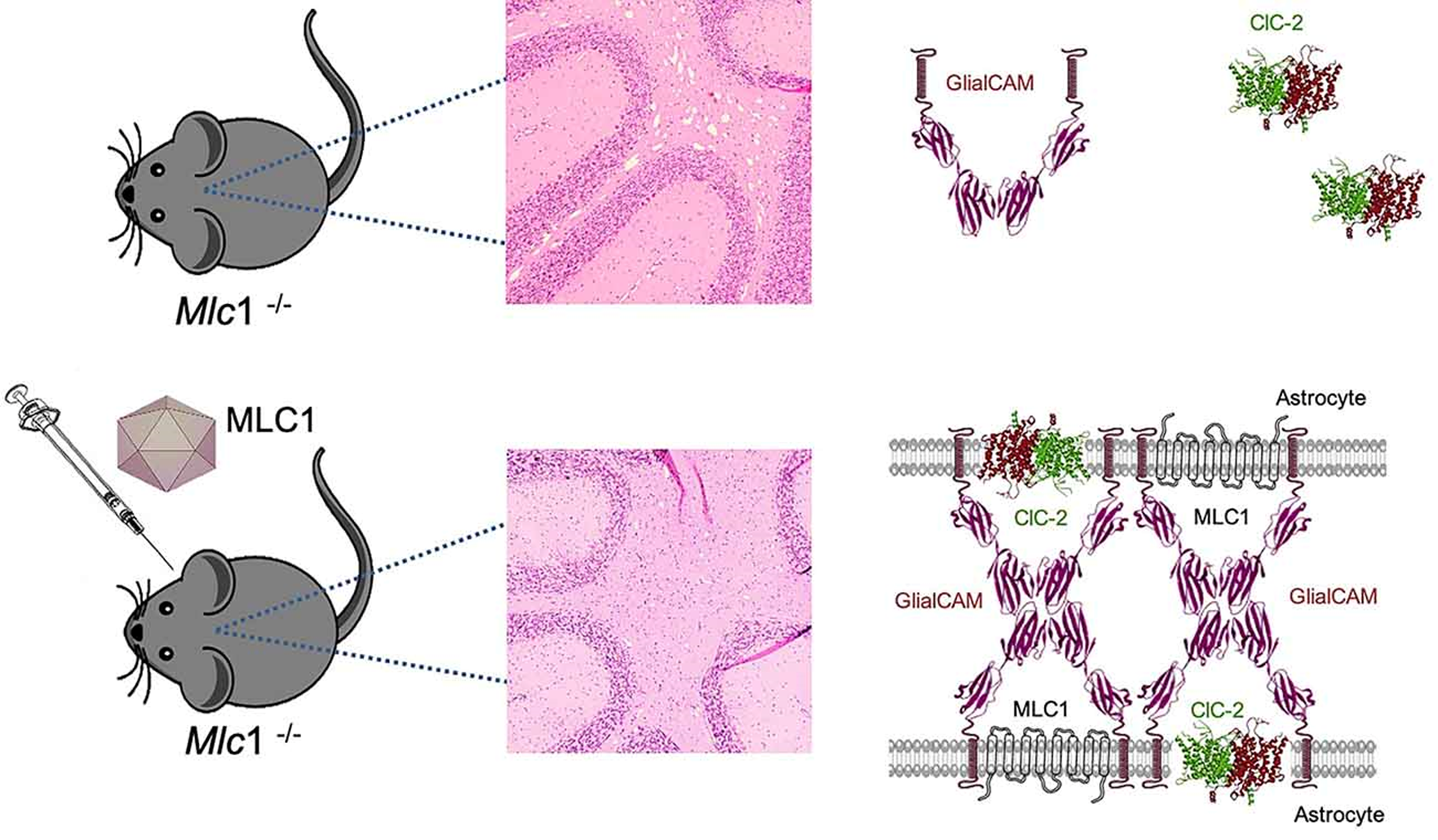
MLC1のAAVによる遺伝子治療
Sanchez et al.(2020): Cerebellar Astrocyte Transduction as Gene Therapy for Megalencephalic Leukoencephalopathy; Neurotherapeutics
. 2020 Oct;17(4):2041-2053; doi : 10.1007/s13311-020-00865-y [PMC]
-
バルセロナ大学の研究グループによる,MLCのメカニズムと,遺伝子治療に関する研究。アデノ随伴ウイルス(AAV)を媒体として,MLC1遺伝子を人為的に変異させたマウスに正常なMLC1遺伝子を導入することで,発症からほぼ1年後の15か月齢(人間に換算して約37歳)のマウスにおいても,無症状のマウスと同様のレベルに回復したことが示されている。このことから,顕著な神経変性はなく臨床表現型は可逆的である可能性があること,また,広い治療域がありどの年齢でも治療できる可能性があることが示唆されている。ただし,自閉症や認知機能低下などの他の表現型は、非常に早い段階での発達過程の変化の結果であり,修正がより難しい可能性があることも示されている。
人間への治療へ展開するための今後の課題として,
・小脳でのみMLCを発現させるだけでこれらの症状を改善できるかどうかの確認
・ヒト以外の霊長類、犬、豚などの大型動物を対象とした検証
などが挙げられている。
話は少しそれるが,この論文中で,ペリツェウス・メルツバッハー様疾患(Cx47;GJC2),カナバン病のマウスに対する AAV を用いた遺伝子治療において有意な表現型の改善をもたらした事例 (Georgiou et al., 2017 ; Gessler et al., 2017) が参照されており,MLC同様に臨床表現型が可逆的である可能性が示唆されている。
遺伝子治療のイメージ(論文より転載)
▼
▲
白質消失病のグリア前駆細胞移植による遺伝子治療
Dooves et al.(2019): Cell Replacement Therapy Improves Pathological Hallmarks in a Mouse Model of Leukodystrophy Vanishing White Matter; Stem Cell Reports
Volume 12, Issue 3, 5 March 2019, Pages 441-450; doi : 10.1016/j.stemcr.2019.01.018
-
VU大学の研究グループによる,同じアストロサイト疾患である白質消失病(VWM)に対する,グリア前駆細胞移植による遺伝子治療アプローチに関する研究。マウスに対し上記治療を行った結果,症状が改善した例が示されている。
この治療法は,ペリツェウス・メルツバッハー病(PMD)の患者(ヒト)に対する臨床試験において有効性が既に確認されており,白質ジストロフィー全般に有効である可能性が示唆されている。
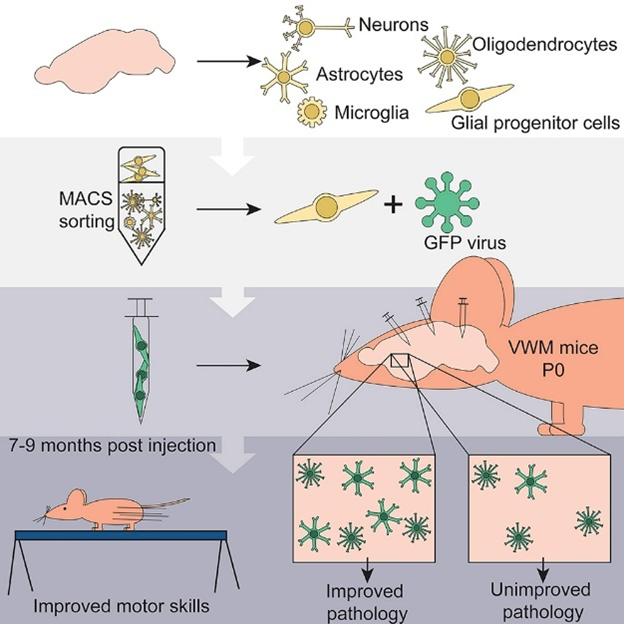
マウスを対象としたグリア細胞移植治療のイメージ(論文より転載)
VWMで遺伝子治療を試みた初めての研究。遺伝子治療ではAAVベクターによる遺伝子導入の方が最近は主流と思われるが,VWMではAAVに関する研究はまだ行われていない。その要因としては,VWMの変異遺伝子であるeIF2Bは,アストロサイトだけでなく,オリゴデンドロサイト,ミクログリアなど複数の細胞にわたって発現されるため,複数細胞をターゲットとした遺伝子導入はAAVでは難しいことが考えられる。神経細胞に分化する前の神経前駆細胞を導入するアプローチの方が,VWMに対しては相性がいいのかもしれない。MLCにおける遺伝子治療検討例は今のところAAVベクターの遺伝子導入アプローチだけだが,グリア前駆細胞移植も有望なアプローチとなる可能性はある。
▼
▲
iPS細胞関連
白質ジストロフィーを対象にiPS細胞を活用した研究事例
Lanciotti et al.(2022): Human iPSC-Derived Astrocytes: A Powerful Tool to Study Primary Astrocyte Dysfunction in the Pathogenesis of Rare Leukodystrophies; Int. J. Mol. Sci. 2022, 23(1), 274; doi : 10.3390/ijms23010274
-
イタリアISSの研究グループによる報告。白質ジストロフィー,特にアストロサイト疾患について,これまで行われたiPS細胞を活用した研究事例が紹介されている。これまでアストロサイト疾患を対象としたiPSC研究は,MLCのほかに,アレキサンダー病(kondo et al.,2016,Li et al.,2018など),白質消失病(Leferink et al.,2019,Zhou et al.,2019),エカルディグディエール症候群(Thomas et al.,2017)などで行われており,そのほとんどが患者由来のiPSCからアストロサイトを分化誘導して分析したものであるが,Li et al.(2018)のみ,アストロサイトとオリゴデンドロサイトを共培養(Co-culture)して,その相互作用を調べている。
MLCのiPSC研究については,Lanciottiらが自ら研究を進めている内容が示されており,MLC患者iPSC由来のアストロサイトを対象とした分析から,これまで報告されていたEGFR / ERK経路の異常な活性化の他に,他の星状細胞障害(AxDおよびVWM)で同様に報告されている酸化的損傷、ミトコンドリア調節不全,小胞体ストレスなどの症状が新たに明らかにされたと示されている(原稿準備中とのこと)。
この他に,プラットフォームとしてのiPSC技術動向についても触れられている。これまで多く行われてきた単独の細胞を分化誘導する手法は2Dモデルと位置付けられ,複数細胞で構成される構造体を丸ごと再現できる最新技術として,3Dモデルと呼ばれる技術も開発されている。Madhavan et al.(2018)では,脳皮質の3Dモデル(皮質スフェロイド)を作成し,ペリツェウス-メルツバッハー病(PMD)の表現型の再現や,薬剤による治療効果の確認が行われたことが示されている。
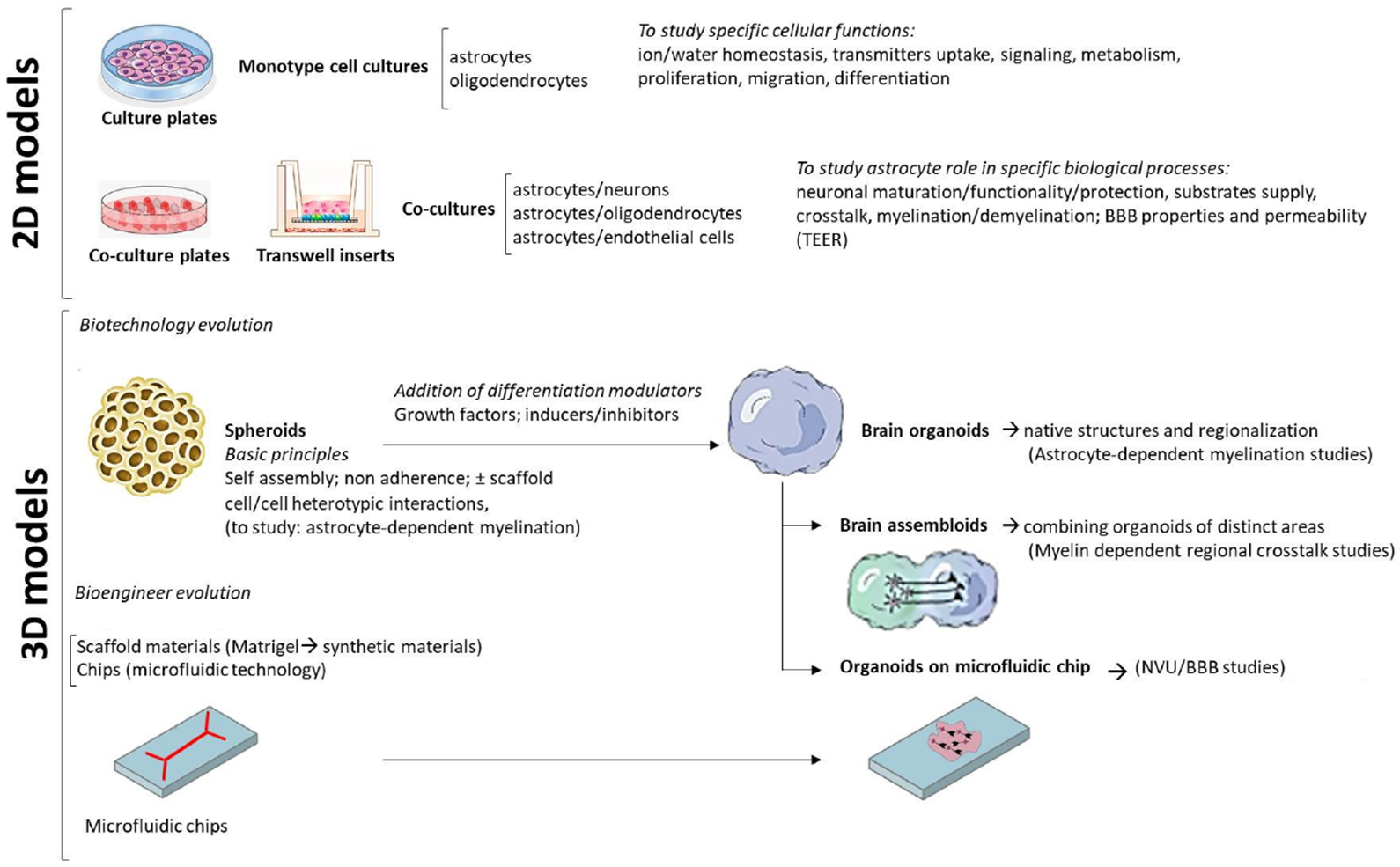
iPS細胞の2Dモデルと3Dモデル(論文より転載)
ISSのiPS細胞を用いたMLC研究により,病態解明がさらに進むことが期待できる。また,アレキサンダー病の事例(Li et al.,2018)に書いたアストロサイトとオリゴデンドロサイトを共培養する2Dモデルや,Madhavan et al.(2018)などに示される3Dモデルは,両細胞の相互作用を再現できるさらに高度なモデルとして今後の展開が期待できる。ただ,特に3Dモデルは最先端過ぎるので,1疾患の治療研究に用いられるにはもう少し時間がかかりそう。
▼
▲
白質消失病を対象としたiPSC研究
Zhou et al.(2019): Modeling vanishing white matter disease with patient-derived induced pluripotent stem cells reveals astrocytic dysfunction; CNS Neurosci Ther. 2019 Jun; 25(6): 759–771. (2019); doi : 10.1111/cns.13107 [PMC]
Deng et al.(2022): Secretomics Alterations and Astrocyte Dysfunction in Human iPSC of Leukoencephalopathy with Vanishing White Matter; Neurochem Res. 2022 Dec;47(12):3747-3760; doi : 10.1007/s11064-022-03765-z
-
北京大学の研究グループによる,VWMのiPS細胞を用いた病態解明に関する研究。いくつか論文が発表されており,2022年の論文ではVWM患者由来のiPS細胞をアストロサイトとオリゴデンドロサイト前駆細胞(OPC)に分化させ,eIF2B変異アストロサイトがOPCの分化や成熟に影響を与える分子を分泌することが示されている。
この研究グループは,MLCの症例報告や病態解明も行っていたグループ。
▼
▲
アレキサンダー病を対象としたiPSC研究
Li et al.(2018): GFAP mutations in astrocytes impair oligodendrocyte progenitor proliferation and myelination in a human iPSC model of Alexander disease; Cell Stem Cell. 2018 Aug 2; 23(2): 239–251.e6.; doi: 10.1016/j.stem.2018.07.009 [PMC]
-
アメリカのベックマン研究所の研究グループによる報告。患者iPSC由来のアストロサイトと健康な人のiPSC由来のオリゴデンドロサイト前駆細胞(OPC)を共培養し,両者の相互作用を調べた研究。共培養したOPCが正常に増殖するか,成熟してオリゴデンドロサイトになるか,そのオリゴデンドロサイトがミエリンを作れるか,などを調べている。オリゴデンドロサイトがミエリンを生成できるかどうかの確認方法は,lee et al.(2012)などで示されている。
AxDに罹患したアストロサイトは,OPCの増殖を阻害し,有髄オリゴデンドロサイトを減少させる結果が得られて,これまでマウスでは再現できていなかった髄鞘形成の欠陥を再現できたことが示されている。
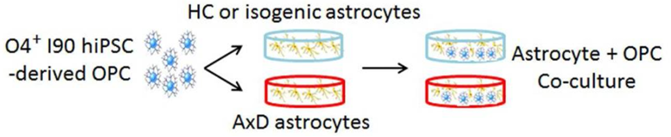
アストロサイトとオリゴデンドロサイトの共培養(論文より転載)
これまでの白質ジストロフィーに関するiPSCを用いた研究はいずれもアストロサイトあるいはオリゴデンドロサイトを単独で分化させるものだったが,この研究はアストロサイトとOPCを共培養した初めての研究(たぶん)。MLCでは,アストロサイトが原因となり,オリゴデンドロサイトの作成するミエリンの空胞化が症状として現れるため,この研究のように両者の相互作用を再現し,さらにミエリン空胞化まで再現できるモデルができれば,病態解明がさらに進むとともに,既存薬などの効果をより明瞭に判断できるツールとなる。
この論文で示された方法で確認できるのは,正常なミエリンを作れるかどうか,というところまでなので,仮に同様の方法をMLCに適用したとして,できたミエリンが空胞化するプロセスが再現できるかどうかは不明。
※lee et al.(2012):ナノファイバーで軸索を模擬して,ミエリンをナノファイバーに巻き付けさせることにより,ミエリン形成能力を定量的に測る手法が提案されている。
▼
▲
アレキサンダー病を対象としたiPSC研究
Kondo et al.(2016): Modeling Alexander disease with patient iPSCs reveals cellular and molecular pathology of astrocytes; Acta Neuropathologica Communications volume 4, Article number: 69 (2016); doi : 10.1186/s40478-016-0337-0 [PMC]
-
京大CiRA,自治医大,熊本大らの研究グループによる,同じアストロサイト疾患であるアレキサンダー病のiPS細胞を用いた病態解明に関する研究。これまでアストロサイトに関する病態研究は,疾患の原因となる遺伝子を強制的に過剰発現させた動物モデルなど頼ってきたが,iPS細胞の技術を用いて,実際の患者さんのアストロサイトを再現することで,病態メカニズムのさらなる解明や創薬開発への展開が期待できる。(参考:CiRAプレスリリース)
MLCに対しても,2021年8月現在イタリアのISSによるヒト由来iPS細胞を用いた研究が進行中らしい。日本でも同様の研究が動き出してくれれば嬉しい。
▼
▲
筋萎縮性側索硬化症(ALS)を対象としたiPSC研究
Imamura et al.(2017): The Src/c-Abl pathway is a potential therapeutic target in amyotrophic lateral sclerosis; Sci Transl Med
. 2017 May 24;9(391):eaaf3962.; doi: 10.1126/scitranslmed.aaf3962
-
筋萎縮性側索硬化症(ALS)について,患者iPS細胞から分化した運動ニューロンを対象とした既存薬スクリーニングにより,Src/c-Ablという経路が影響を受けること,ボスチニブというSrc/c-Abl経路の活性化を阻害する薬剤が有効であるという知見が示されている。これを受けて,2019年に患者を対象とした臨床試験を開始したことが報告されている。
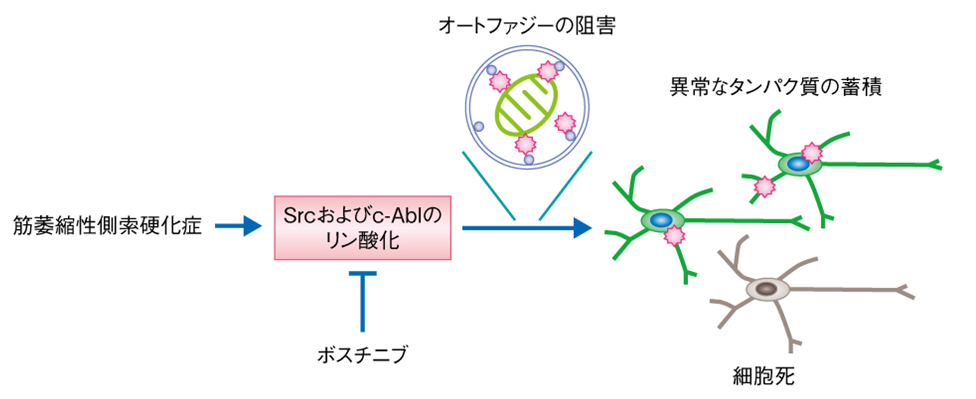
筋萎縮性側索硬化症の患者の運動ニューロンにおける病態(論文レビューサイトより)
ALSは全く違う病気ではあるが,遺伝子変異に起因するシグナル伝達経路の過剰活性が悪さしていると考えられている点,その阻害剤が有効である可能性がある点で共通しているので,何かしら参考になることがあるかもしれない。
ただ,ALSではニューロンの細胞死という明確な症状がiPSCで再現できているのに対し,MLCの症状として明瞭な指標となり得るミエリン空胞化はアストロサイトとオリゴデンドロサイトの相互作用まで再現する必要があり,既存薬スクリーニングにおいてはその点でより高いハードルがあると思われる。
▼
▲
その他
白質消失病(VWM)の臨床試験に関する報告
Dooves et al.(2017): Bergmann glia translocation: a new disease marker for vanishing white matter identifies therapeutic effects of Guanabenz treatment; Neuropathol Appl Neurobiol
. 2018 Jun;44(4):391-403. doi: 10.1111/nan.12411
-
VU大学による,同じアストロサイト疾患である白質消失病(VWM)に対する治療法に関する研究。この論文では,グアナベンズと呼ばれる高血圧の治療に何十年も使用されてきた薬が、VWMに罹患したマウスに対し有効であるという結果が示されている。それを受けて,オランダのアムステルダム大学医療センターにおいて,VWMの子供を対象とした臨床試験が実施されている(web記事; 白質消失病の患者を対象とした臨床試験を開始)。
VWMはeIF2Bという遺伝子変異に起因しており,グアナベンズはeIF2Bタンパクの活性を調節する効果あるとのことなので,MLCの治療に直接反映できる可能性は低いと思われる。ただし,この例のように,既に別の役割で用いられている薬が特定の疾患に思わぬ効果を発揮するということもあり得るので,今後MLCにおいても既存薬の有効性が示されることを期待したい。
▼
▲